题目内容
15.NA为阿伏加德罗常数的值.下列说法中,正确的是( )| A. | 标准状况下,22.4 L庚烷的分子数约为NA | |
| B. | 密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.4NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
分析 A、标况下,庚烷为液态;
B、NO2与N2O4的最简式均为NO2;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价;
D、HCO3-在溶液中既能水解为H2CO3又能电离为CO32-;
解答 解:A、标况下,庚烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、NO2与N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量为n=$\frac{23g}{46g/mol}$=0.5mol,则含0.5NA个氮原子,故B正确;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C错误;
D、HCO3-在溶液中既能水解为H2CO3又能电离为CO32-,根据物料守恒可知:溶液中的HCO3-、H2CO3、CO32-之和为0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 同系物的化学性质相似 | |
| B. | 甲烷、乙烷互为同系物 | |
| C. | 分子式相同,结构不同的化合物互称为同分异构体 | |
| D. | 同分异构体之间的转化属于物理变化 |
6.下列叙述中正确的是( )
| A. | 1.8 g的NH4+中含有的电子数为0.1×6.02×1023 | |
| B. | 常温常压下,11.2 L氯气所含的原子数为6.02×1023 | |
| C. | 常温常压下,18 g H2O含有的原子数为3×6.02×1023 | |
| D. | 5.6 g金属铁变为离子时失去的电子数为0.2×6.02×1023 |
3.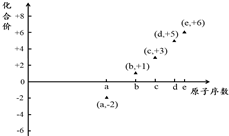 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
 如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d属于同种核素 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |
10.下列说法中,不正确的是( )
| A. |  钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | |
| B. |  钢铁表面水膜的酸性较强,发生析氢腐蚀 | |
| C. |  将锌板换成铜板对钢闸门保护效果更好 | |
| D. |  钢闸门作为阴极而受到保护 |
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2 g H2所含原子数目为NA | |
| B. | 64 g SO2中含有的原子数为3 NA | |
| C. | 常温常压下,11.2 L Cl2含有的分子数为0.5 NA | |
| D. | 1 mol/L NaOH溶液中Na+的数目为NA |
4.随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
| A. | 无水硫酸铜、蔗糖 | B. | 食盐、硫酸亚铁 | C. | 生石灰、硫酸亚铁 | D. | 硅胶、食盐 |
5.下列物质的分类依据、类别、性质三者之间对应关系完全正确的是( )
| 物质 | 分类依据 | 类别 | 性质 | |
| A | FeCl2 | 铁元素化合价 | 还原剂 | 可与O2、Zn等发生反应 |
| B | FeCl2 | 电离产生的微粒 | 盐 | 可发生水解反应,溶液显碱性 |
| C | HNO3 | 在水中能电离出H+ | 酸 | 可与CuO反应生成NO |
| D | HNO3 | 氮元素的化合价 | 氧化剂 | 可与Al、I-等发生反应 |
| A. | A | B. | B | C. | C | D. | D |
 .
.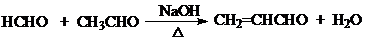 .
.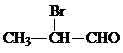 .
. .
.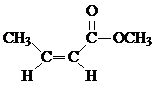 .
.