题目内容
现将金属镁和铝的混合物7.5g完全溶解于一定浓度的硝酸溶液中,收集反应产生的A气体.向所得溶液中加入过量烧碱溶液,得到沉淀11.6g.则气体A的成分可能是( )
A、0.2mol NO和0.1molNO2 B、0.3molNO
C、0.1molNO、0.2molNO2和0.1molN2O4 D、0.3molNO2和0.1molN2O4.
A、0.2mol NO和0.1molNO2 B、0.3molNO
C、0.1molNO、0.2molNO2和0.1molN2O4 D、0.3molNO2和0.1molN2O4.
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:Mg、Al混合物与硝酸反应生成硝酸镁、硝酸铝与氮的氧化物,加入过量的氢氧化钠溶液,镁离子转化为Mg(OH)2沉淀,铝离子转化为偏铝酸根,11.6g沉淀全部是Mg(OH)2的质量,根据m=
计算氢氧化镁的物质的量,再根据m=nM计算Mg的质量,进而计算Al的质量,根据电子转移守恒,结合选项判断.
| m |
| M |
解答:
解:Mg、Al混合物与硝酸反应生成硝酸镁、硝酸铝与氮的氧化物,加入过量的氢氧化钠溶液,镁离子转化为Mg(OH)2沉淀,铝离子转化为偏铝酸根,11.6g沉淀全部是Mg(OH)2的质量,氢氧化镁的物质的量=
=0.2mol,故Mg的质量=0.2mol×24g/mol=4.8g,则Al的质量=7.5g-4.8g=2.7g,Al的物质的量=
=0.1mol,转移电子物质的量=0.2mol×2+0.1mol×3=0.7mol,
A.生成0.2mol NO和0.1molNO2,N元素获得电子为0.2mol×(5-2)+0.1mol×(5-4)=0.7mol,得失电子相等,故A正确;
B.生成0.3mol NO和,N元素获得电子为0.3mol×(5-2)=0.9mol,得失电子不相等,故B错误;
C.生成0.1mol NO、0.2mol NO2和0.1mol N2O4,N元素获得电子为0.1mol×(5-2)+0.2mol×(5-4)+0.1mol×2×(5-4)=0.7mol,得失电子相等,故C正确;
D.生成0.3mo1NO2和0.1mo1N2O4,N元素获得电子为0.3mol×(5-4)+0.1mol×2×(5-4)=0.5mol,得失电子不相等,故C错误,
故选AC.
| 11.6g |
| 58g/mol |
| 2.7g |
| 27g/mol |
A.生成0.2mol NO和0.1molNO2,N元素获得电子为0.2mol×(5-2)+0.1mol×(5-4)=0.7mol,得失电子相等,故A正确;
B.生成0.3mol NO和,N元素获得电子为0.3mol×(5-2)=0.9mol,得失电子不相等,故B错误;
C.生成0.1mol NO、0.2mol NO2和0.1mol N2O4,N元素获得电子为0.1mol×(5-2)+0.2mol×(5-4)+0.1mol×2×(5-4)=0.7mol,得失电子相等,故C正确;
D.生成0.3mo1NO2和0.1mo1N2O4,N元素获得电子为0.3mol×(5-4)+0.1mol×2×(5-4)=0.5mol,得失电子不相等,故C错误,
故选AC.
点评:本题考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.

练习册系列答案
相关题目
 某同学按如图所示的装置进行电解实验.下列说法正确的是( )
某同学按如图所示的装置进行电解实验.下列说法正确的是( )| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极不可能有铜析出 | ||||
C、电解初期,主反应方程式为:Cu+H2SO4
| ||||
| D、整个电解过程中,H+的浓度不断增大 |
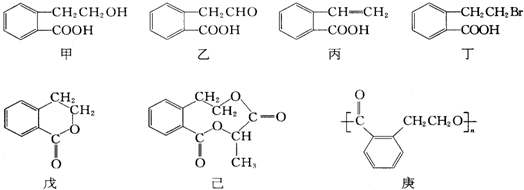
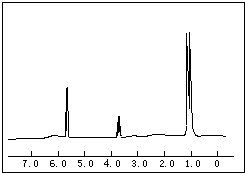 (1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇:
(1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇: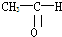 烯烃:
烯烃: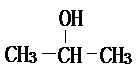 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为: