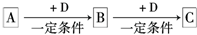��Ŀ����
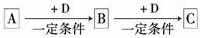 ��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ��������������ת����ϵ��
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ��������������ת����ϵ��
��1����A��ʹʪ��ĺ�ɫʯ����ֽ������CΪ����ɫ���壬��Aת��ΪB��Ӧ�Ļ�ѧ����Ϊ______��
��2����D�Ǿ��������Եĵ��ʣ�AԪ�����ڶ������������Ԫ�أ���C�ĵ���ʽΪ______��
��3����D�ǽ�����C��Һ������ʱӦ��������D���������ǣ������ӷ���ʽ˵����______��
��4����D��һ�ֳ������������壻A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ���Bת��ΪC�����ӷ���ʽΪ______��
�⣺��1��A��ʹʪ��ĺ�ɫʯ����ֽ������ӦΪNH3��CΪ����ɫ���壬ӦΪNO2����BΪNO��DΪO2��Aת��ΪB��Ӧ�Ļ�ѧ����Ϊ4NH3+5O2 4NO+6H2O��
4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2 4NO+6H2O��
4NO+6H2O��
��2��D�Ǿ��������Եĵ��ʣ�AԪ�����ڶ������������Ԫ�أ����ݷ�Ӧ��ϵ��֪ӦΪNa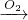 Na2O
Na2O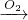 Na2O2�ķ�Ӧ��CΪNa2O2������ʽΪ
Na2O2�ķ�Ӧ��CΪNa2O2������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��3���ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe����Ӧ��ԭ��Ϊ2Fe3++Fe=3Fe2+���ʴ�Ϊ��2Fe3++Fe=3Fe2+��
��4��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3��
Bת��ΪC�����ӷ���ʽΪCO2+CO32-+H2O=2HCO3-���ʴ�Ϊ��CO2+CO32-+H2O=2HCO3-��
��������1��A��ʹʪ��ĺ�ɫʯ����ֽ������ӦΪNH3��CΪ����ɫ���壬ӦΪNO2����BΪNO��DΪO2��
��2��D�Ǿ��������Եĵ��ʣ�AԪ�����ڶ������������Ԫ�أ����ݷ�Ӧ��ϵ��֪ӦΪNa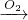 Na2O
Na2O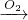 Na2O2�ķ�Ӧ��
Na2O2�ķ�Ӧ��
��3��D�ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe��
��4��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3��������ʵ����ʽ����⣮
���������⿼��������ƶϣ���Ŀ�ѶȲ�����ע����շ�Ӧ��ת���ص㣬�������ʵ����ʡ���;��Ϊ����ͻ�ƿڣ�
 4NO+6H2O��
4NO+6H2O���ʴ�Ϊ��4NH3+5O2
 4NO+6H2O��
4NO+6H2O����2��D�Ǿ��������Եĵ��ʣ�AԪ�����ڶ������������Ԫ�أ����ݷ�Ӧ��ϵ��֪ӦΪNa
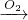 Na2O
Na2O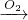 Na2O2�ķ�Ӧ��CΪNa2O2������ʽΪ
Na2O2�ķ�Ӧ��CΪNa2O2������ʽΪ ��
���ʴ�Ϊ��
 ��
����3���ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe����Ӧ��ԭ��Ϊ2Fe3++Fe=3Fe2+���ʴ�Ϊ��2Fe3++Fe=3Fe2+��
��4��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3��
Bת��ΪC�����ӷ���ʽΪCO2+CO32-+H2O=2HCO3-���ʴ�Ϊ��CO2+CO32-+H2O=2HCO3-��
��������1��A��ʹʪ��ĺ�ɫʯ����ֽ������ӦΪNH3��CΪ����ɫ���壬ӦΪNO2����BΪNO��DΪO2��
��2��D�Ǿ��������Եĵ��ʣ�AԪ�����ڶ������������Ԫ�أ����ݷ�Ӧ��ϵ��֪ӦΪNa
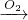 Na2O
Na2O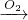 Na2O2�ķ�Ӧ��
Na2O2�ķ�Ӧ����3��D�ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe��
��4��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3��������ʵ����ʽ����⣮
���������⿼��������ƶϣ���Ŀ�ѶȲ�����ע����շ�Ӧ��ת���ص㣬�������ʵ����ʡ���;��Ϊ����ͻ�ƿڣ�

��ϰ��ϵ�д�
�����Ŀ

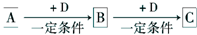
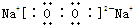
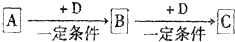 ��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��