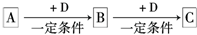��Ŀ����
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ��������������ת����ϵ��A
B
C
��1����A��һ�ֽ������壬C�ǵ���ɫ���壬��C�Ļ�ѧʽΪ
��2����A��B��C����ɫ��Ӧ��Ϊ��ɫ��A��һ�ֹ�ҵԭ�ϣ�B�׳�С�մ��C��ˮ��Һ���Եõ�������̬�����������̬�����ڹ�ҵ�Ͽ��Ժϳ�X������C��ˮ��Һ�����ӷ���ʽΪ
����B���Ƿ���A���Լ�������
��HCl ��BaCl2��Ca��OH��2 ��CaCl2
��3����AΪ��ɫ�ǽ������ʣ�C����ɵ�������ЧӦ��������ף�C�������þ������Ӧ���仯ѧ����ʽΪ
| X |
| X |
��1����A��һ�ֽ������壬C�ǵ���ɫ���壬��C�Ļ�ѧʽΪ
Na2O2
Na2O2
��C��ˮ��Ӧ�����ӷ���ʽΪ2Na2O2+2H2O=4Na++4OH-+O2��
2Na2O2+2H2O=4Na++4OH-+O2��
��2����A��B��C����ɫ��Ӧ��Ϊ��ɫ��A��һ�ֹ�ҵԭ�ϣ�B�׳�С�մ��C��ˮ��Һ���Եõ�������̬�����������̬�����ڹ�ҵ�Ͽ��Ժϳ�X������C��ˮ��Һ�����ӷ���ʽΪ
2Cl-+2H2O
2OH-+H2��+Cl2��
| ||
2Cl-+2H2O
2OH-+H2��+Cl2��
B��Һ��X��Һ��Ӧ�����ӷ���ʽΪ
| ||
HCO3-+H+=H2O+CO2��
HCO3-+H+=H2O+CO2��
����B���Ƿ���A���Լ�������
�ڢ�
�ڢ�
������ţ�����HCl ��BaCl2��Ca��OH��2 ��CaCl2
��3����AΪ��ɫ�ǽ������ʣ�C����ɵ�������ЧӦ��������ף�C�������þ������Ӧ���仯ѧ����ʽΪ
CO2+2Mg
C+2MgO
| ||
CO2+2Mg
C+2MgO
��
| ||
��������1������������Ӧ����CΪ����ɫ���壬�ж�ΪNa2O2���������ƺ�ˮ��Ӧ�����������ƺ�������
��2����A��B��C����ɫ��Ӧ��Ϊ��ɫ˵������Ԫ�أ�A��һ�ֹ�ҵԭ�ϣ��ƶ�ΪNa2CO3��B�׳�С�մ�ΪNaHCO3�����C��ˮ��Һ���Եõ�������̬�����������̬�����ڹ�ҵ�Ͽ��Ժϳ�X�����ݹ�ҵ�Ƽ�����жϣ�������NaCl��Һ������������������������������Ӧ�����Ȼ��⣻B�����ᷴӦ���ɶ�����̼��ˮ���Ȼ��ƣ�̼���ƺ�̼�����Ƶļ������������Ȼ������Ȼ��ƺ�̼���Ʒ�Ӧ���ɳ������������̼���ƺ�̼�����ƶ��ܷ�Ӧ���ɶ�����̼���壬�������ƺ�̼���ơ�̼�����Ʒ�Ӧ�������ɳ�����
��3����AΪ��ɫ�ǽ������ʣ�C����ɵ�������ЧӦ����������ж�ΪCO2��CO2�������þ������Ӧ��������þ��̼���ʣ�����ת����ϵ������AΪC��BΪCO��CΪCO2��xΪO2��
��2����A��B��C����ɫ��Ӧ��Ϊ��ɫ˵������Ԫ�أ�A��һ�ֹ�ҵԭ�ϣ��ƶ�ΪNa2CO3��B�׳�С�մ�ΪNaHCO3�����C��ˮ��Һ���Եõ�������̬�����������̬�����ڹ�ҵ�Ͽ��Ժϳ�X�����ݹ�ҵ�Ƽ�����жϣ�������NaCl��Һ������������������������������Ӧ�����Ȼ��⣻B�����ᷴӦ���ɶ�����̼��ˮ���Ȼ��ƣ�̼���ƺ�̼�����Ƶļ������������Ȼ������Ȼ��ƺ�̼���Ʒ�Ӧ���ɳ������������̼���ƺ�̼�����ƶ��ܷ�Ӧ���ɶ�����̼���壬�������ƺ�̼���ơ�̼�����Ʒ�Ӧ�������ɳ�����
��3����AΪ��ɫ�ǽ������ʣ�C����ɵ�������ЧӦ����������ж�ΪCO2��CO2�������þ������Ӧ��������þ��̼���ʣ�����ת����ϵ������AΪC��BΪCO��CΪCO2��xΪO2��
����⣺��1����A��һ�ֽ������壬C�ǵ���ɫ���壬����ת����ϵ���ж�AΪNa����ӦΪNa
Na2O
Na2O2��CΪNa2O2������������ˮ��Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH-+O2�����ʴ�Ϊ��2Na2O2+2H2O=4Na++4OH-+O2����
��2����A��B��C����ɫ��Ӧ��Ϊ��ɫ˵������Ԫ�أ�A��һ�ֹ�ҵԭ�ϣ��ƶ�ΪNa2CO3��B�׳�С�մ�ΪNaHCO3�����C��ˮ��Һ���Եõ�������̬�����������̬�����ڹ�ҵ�Ͽ��Ժϳ�X�����ݹ�ҵ�Ƽ�����жϣ�������NaCl��Һ������������������������������Ӧ�����Ȼ��⣻���C��ˮ��Һ�����ӷ���ʽΪ��2Cl-+2H2O
2OH-+H2��+Cl2����B�����ᷴӦ���ɶ�����̼��ˮ���Ȼ��ƣ���Ӧ�����ӷ���ʽΪ��HCO3-+H+=H2O+CO2����
̼���ƺ�̼�����Ƶļ������������Ȼ������Ȼ��ƺ�̼���Ʒ�Ӧ���ɳ�������Ba2++CO32-=BaCO3����Ca2++CO32-=CaCO3���������̼���ƺ�̼�����ƶ��ܷ�Ӧ���ɶ�����̼���壬��Ӧ�����ӷ���ʽΪ��CO32-+2H+=CO2��+H2O��HCO3-+H+=CO2��+H2O�����Բ�������������������ƺ�̼���ơ�̼�����Ʒ�Ӧ�������ɳ�������Ӧ�����ӷ���ʽΪ��Ca2++CO32-=CaCO3����Ca2++2OH-+2HCO3-=2H2O+CaCO3��+CO32-�����Բ������������Ƽ��飬��ѡ�ڢܣ�
��3������ת����ϵ����AΪ��ɫ�ǽ������ʣ�C����ɵ�������ЧӦ����������ж�ΪCO2��CO2�������þ������Ӧ��������þ��̼���ʣ�����ת����ϵ������AΪC��BΪCO��CΪCO2��xΪO2�����Զ�����̼��þ��Ӧ�Ļ�ѧ����ʽΪCO2+2Mg
C+2MgO���ʴ�Ϊ��CO2+2Mg
C+2MgO��
| O2 |
| O2 |
��2����A��B��C����ɫ��Ӧ��Ϊ��ɫ˵������Ԫ�أ�A��һ�ֹ�ҵԭ�ϣ��ƶ�ΪNa2CO3��B�׳�С�մ�ΪNaHCO3�����C��ˮ��Һ���Եõ�������̬�����������̬�����ڹ�ҵ�Ͽ��Ժϳ�X�����ݹ�ҵ�Ƽ�����жϣ�������NaCl��Һ������������������������������Ӧ�����Ȼ��⣻���C��ˮ��Һ�����ӷ���ʽΪ��2Cl-+2H2O
| ||
̼���ƺ�̼�����Ƶļ������������Ȼ������Ȼ��ƺ�̼���Ʒ�Ӧ���ɳ�������Ba2++CO32-=BaCO3����Ca2++CO32-=CaCO3���������̼���ƺ�̼�����ƶ��ܷ�Ӧ���ɶ�����̼���壬��Ӧ�����ӷ���ʽΪ��CO32-+2H+=CO2��+H2O��HCO3-+H+=CO2��+H2O�����Բ�������������������ƺ�̼���ơ�̼�����Ʒ�Ӧ�������ɳ�������Ӧ�����ӷ���ʽΪ��Ca2++CO32-=CaCO3����Ca2++2OH-+2HCO3-=2H2O+CaCO3��+CO32-�����Բ������������Ƽ��飬��ѡ�ڢܣ�
��3������ת����ϵ����AΪ��ɫ�ǽ������ʣ�C����ɵ�������ЧӦ����������ж�ΪCO2��CO2�������þ������Ӧ��������þ��̼���ʣ�����ת����ϵ������AΪC��BΪCO��CΪCO2��xΪO2�����Զ�����̼��þ��Ӧ�Ļ�ѧ����ʽΪCO2+2Mg
| ||
| ||
���������⿼��������ת����ϵ�ķ����������������ʵ��ۺ�Ӧ�ã���Ӧ����Ӧԭ���ǽ���ؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ

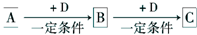
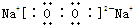
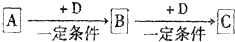 ��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��