��Ŀ����
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ��������������ת����ϵ��
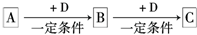
��1����A��ʹʪ��ĺ�ɫʯ����ֽ������CΪ����ɫ���壮��Aת��ΪB��Ӧ�Ļ�ѧ����ʽΪ ��
��2����D�ǽ�����C��Һ������ʱӦ��������D���������ǣ��ñ�Ҫ�����ֺ����ӷ���ʽ˵���� ��
��3����D��һ�ֳ������������壬A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�����C���ȷֽ�ɵù���B���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4����DΪ�ȼҵ����Ҫ��Ʒ��B�������ԣ���Bת��ΪC�����ӷ���ʽΪ ��
��5����A��B��C��Ϊ�����D��һ�ֺ�ɫ��̬�ǽ������ʣ���Ԫ��D�����ڱ��е�λ���� ��B���ӵĽṹʽΪ ��
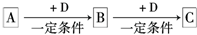
��1����A��ʹʪ��ĺ�ɫʯ����ֽ������CΪ����ɫ���壮��Aת��ΪB��Ӧ�Ļ�ѧ����ʽΪ
��2����D�ǽ�����C��Һ������ʱӦ��������D���������ǣ��ñ�Ҫ�����ֺ����ӷ���ʽ˵����
��3����D��һ�ֳ������������壬A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�����C���ȷֽ�ɵù���B���÷�Ӧ�Ļ�ѧ����ʽ��
��4����DΪ�ȼҵ����Ҫ��Ʒ��B�������ԣ���Bת��ΪC�����ӷ���ʽΪ
��5����A��B��C��Ϊ�����D��һ�ֺ�ɫ��̬�ǽ������ʣ���Ԫ��D�����ڱ��е�λ����
��������1��A��ʹʪ��ĺ�ɫʯ����ֽ������ӦΪNH3��CΪ����ɫ���壬ӦΪNO2����BΪNO��DΪO2��
��2��D�ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe��
��3��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3��
��4��B�������ԣ�����D��Ӧ����DΪ�ȼҵ����Ҫ��Ʒ����DΪNaOH��BΪAl��OH��3��CΪNaAlO2��
��5��D��һ�ֺ�ɫ��̬�ǽ������ʣ�ӦΪC����BΪCO2��CΪCO��
��2��D�ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe��
��3��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3��
��4��B�������ԣ�����D��Ӧ����DΪ�ȼҵ����Ҫ��Ʒ����DΪNaOH��BΪAl��OH��3��CΪNaAlO2��
��5��D��һ�ֺ�ɫ��̬�ǽ������ʣ�ӦΪC����BΪCO2��CΪCO��
����⣺��1��A��ʹʪ��ĺ�ɫʯ����ֽ������ӦΪNH3��CΪ����ɫ���壬ӦΪNO2����BΪNO��DΪO2��Aת��ΪB��Ӧ�Ļ�ѧ����ʽΪ4NH3+5O2
4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2
4NO+6H2O��
��2��D�ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe����Ӧ��ԭ��Ϊ2Fe3++Fe=3Fe2+��
�ʴ�Ϊ����ֹFe2+��������2Fe3++Fe=3Fe2+��
��3��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3������C���ȷֽ�ɵù���B���÷�Ӧ�Ļ�ѧ����ʽ��2NaHCO3
Na2CO3+H2O+CO2����
�ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2����
��4��B�������ԣ�����D��Ӧ����DΪ�ȼҵ����Ҫ��Ʒ����DΪNaOH��BΪAl��OH��3��CΪNaAlO2��Bת��ΪC�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��5��D��һ�ֺ�ɫ��̬�ǽ������ʣ�ӦΪC����BΪCO2��CΪCO��Cλ�����ڱ���2���ڡ��ڢ�A�壬CO2�ĽṹʽΪO=C=O���ʴ�Ϊ����2���ڡ��ڢ�A�壻O=C=O��
| ||
| �� |
�ʴ�Ϊ��4NH3+5O2
| ||
| �� |
��2��D�ǽ�����C��Һ������ʱӦ��������D��˵��C�ױ����������ʣ���AΪCl2��BΪFeCl3��CΪFeCl2��DΪFe����Ӧ��ԭ��Ϊ2Fe3++Fe=3Fe2+��
�ʴ�Ϊ����ֹFe2+��������2Fe3++Fe=3Fe2+��
��3��D��һ�ֳ������������壬ӦΪCO2��A��һ��ǿ���������ˮ��Һ�е���������������Ӿ�����10�����ӣ�ӦΪNaOH����BΪNa2CO3��CΪNaHCO3������C���ȷֽ�ɵù���B���÷�Ӧ�Ļ�ѧ����ʽ��2NaHCO3
| ||
�ʴ�Ϊ��2NaHCO3
| ||
��4��B�������ԣ�����D��Ӧ����DΪ�ȼҵ����Ҫ��Ʒ����DΪNaOH��BΪAl��OH��3��CΪNaAlO2��Bת��ΪC�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��5��D��һ�ֺ�ɫ��̬�ǽ������ʣ�ӦΪC����BΪCO2��CΪCO��Cλ�����ڱ���2���ڡ��ڢ�A�壬CO2�ĽṹʽΪO=C=O���ʴ�Ϊ����2���ڡ��ڢ�A�壻O=C=O��
���������⿼��������ƶϣ�Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ��������Ŀ��飬��Ŀ�ѶȲ�����ע����շ�Ӧ��ת���ص㣬�������ʵ����ʡ���;��Ϊ����ͻ�ƿڣ�

��ϰ��ϵ�д�
�����Ŀ

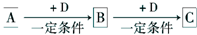
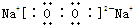
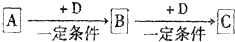 ��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��
��֪A��B��C����ѧ��ѧ�ij������ʣ�������һ������������ͼ��ʾת����ϵ��