题目内容
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图1所示.
(1)此配合物中,铁离子的价电子排布式为 .
(2)此配合物的-C2H5中C-H间形成化学键的原子轨道分别是 ; .
Ⅱ、(1)已知CrO5中Cr为+6价,则CrO5的结构式为 .
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为 (写出一个即可).
(3)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.已知CuH晶体结构单元如图2所示.该化合物的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示).
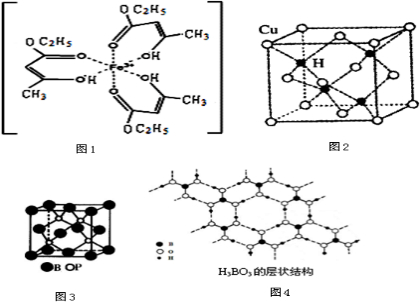
Ⅲ、硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为,B原子的杂化类型为 .
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层.如图3示意的是磷化硼的晶体结构单元,则磷化硼的化学式为,微粒间存在的作用力为 .
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如图4).
①1mol H3BO3的晶体中有 mol氢键.
②硼酸溶于水应生成弱电解质一水合硼酸H2O?B(OH)3,它电离生成少量[B(OH)4]-和的H+离子.则硼酸为元酸,[B(OH)4]-含有的化学键类型为 .
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图1所示.
(1)此配合物中,铁离子的价电子排布式为
(2)此配合物的-C2H5中C-H间形成化学键的原子轨道分别是
Ⅱ、(1)已知CrO5中Cr为+6价,则CrO5的结构式为
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为
(3)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.已知CuH晶体结构单元如图2所示.该化合物的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为

Ⅲ、硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为,B原子的杂化类型为
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层.如图3示意的是磷化硼的晶体结构单元,则磷化硼的化学式为,微粒间存在的作用力为
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如图4).
①1mol H3BO3的晶体中有
②硼酸溶于水应生成弱电解质一水合硼酸H2O?B(OH)3,它电离生成少量[B(OH)4]-和的H+离子.则硼酸为元酸,[B(OH)4]-含有的化学键类型为
考点:原子核外电子排布,化学键,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:Ⅰ.(1)铁元素是26号元素,铁原子核外有26个电子,铁原子失去3个电子变成铁离子,根据构造原理写出其价电子排布式;
(2)根据碳原子含有的σ键和孤电子对个数确定杂化类型,碳原子的杂化轨道和氢原子的1s轨道形成化学键;
Ⅱ、(1)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(2)Ni(CO)4中配体是CO,CO的等电子体是与其原子个数相等且价电子数相等的分子或离子;
(3)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算;
Ⅲ、(1)首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型;
(2)根据磷化硼的晶体结构解答;
(3)①利用均摊法计算含1molH3BO3的晶体中的氢键;
②B原子外层3个电子,硼酸(H3BO3)结合水电离出的氢氧根离子显较弱的酸性;
(2)根据碳原子含有的σ键和孤电子对个数确定杂化类型,碳原子的杂化轨道和氢原子的1s轨道形成化学键;
Ⅱ、(1)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(2)Ni(CO)4中配体是CO,CO的等电子体是与其原子个数相等且价电子数相等的分子或离子;
(3)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算;
Ⅲ、(1)首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型;
(2)根据磷化硼的晶体结构解答;
(3)①利用均摊法计算含1molH3BO3的晶体中的氢键;
②B原子外层3个电子,硼酸(H3BO3)结合水电离出的氢氧根离子显较弱的酸性;
解答:
解:I.(1)铁元素是26号元素,其原子核外有26个电子,铁原子失去3个电子变成铁离子,其价电子排布式为:3d5,
故答案为:3d5;
(2)甲基和乙基上的碳原子含有4个σ键且不含孤电子对,采用sp3杂化,所以C2H5中C-H间碳原子的sp3杂化轨道和氢原子的1s轨道形成化学键,
故答案为:碳原子的sp3杂化轨道和氢原子的1s轨道;
II.(1)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为 ,
,
故答案为: ;
;
(2)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-、C22-、O22+,
故答案为:CN-、C22-、O22+;
(3)该晶胞中含有4个H原子,铜原子个数=
×8+6×
=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则该晶胞中Cu原子与H原子之间的最短距离为:
a,则a=
=
,该晶胞中Cu原子与H原子之间的最短距离为:
×
,
故答案为:
×
;
Ⅲ、(1)BF3中B原子形成3个δ键,孤对电子数为
=0,BF3中价层电子对个数=3+
×(3-3×1)=3,且不含孤电子对,所以空间构型是平面三角形,中心原子是以sp2杂化,
故答案为:平面三角形;sp2;
(2)由图可知,B原子分别与三个P原子形成共价键,则磷化硼的化学式为BP,所以微粒间存在的作用力为共价键,
故答案为:BP;共价键;
(3)①一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,
故答案为:3;
②硼酸中B原子属于缺电子原子,在水溶液中结合水电离出的氢氧根离子,B(OH)3+H2O?B(OH)4-+H+,破坏了水的电离平衡而使溶液显酸性,所以硼酸为一元酸,[B(OH)4]-含有的化学键类型为共价键、配位键,
故答案为:一;共价键、配位键;
故答案为:3d5;
(2)甲基和乙基上的碳原子含有4个σ键且不含孤电子对,采用sp3杂化,所以C2H5中C-H间碳原子的sp3杂化轨道和氢原子的1s轨道形成化学键,
故答案为:碳原子的sp3杂化轨道和氢原子的1s轨道;
II.(1)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为
 ,
,故答案为:
 ;
;(2)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-、C22-、O22+,
故答案为:CN-、C22-、O22+;
(3)该晶胞中含有4个H原子,铜原子个数=
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 4 |
| 3 |
| ||||
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
故答案为:
| ||
| 4 |
| 3 |
| ||
Ⅲ、(1)BF3中B原子形成3个δ键,孤对电子数为
| 3-3×1 |
| 2 |
| 1 |
| 2 |
故答案为:平面三角形;sp2;
(2)由图可知,B原子分别与三个P原子形成共价键,则磷化硼的化学式为BP,所以微粒间存在的作用力为共价键,
故答案为:BP;共价键;
(3)①一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,
故答案为:3;
②硼酸中B原子属于缺电子原子,在水溶液中结合水电离出的氢氧根离子,B(OH)3+H2O?B(OH)4-+H+,破坏了水的电离平衡而使溶液显酸性,所以硼酸为一元酸,[B(OH)4]-含有的化学键类型为共价键、配位键,
故答案为:一;共价键、配位键;
点评:本题考查较为综合,题目难度中等,涉及晶胞的计算、价电子排布式的书写、等电子体等知识点,对学生的空间想象有一定要求,侧重考查学生对知识的迁移应用.注意信息的理解和综合应用.

练习册系列答案
相关题目
下列说法正确的是( )
| A、用新制氢氧化铜悬浊液可检验失去标签的乙醇、丙三醇、乙醛、乙酸四瓶无色溶液 |
| B、检验氯乙烷中的氯元素时,可先将氯乙烷硝酸进行酸化,再加硝酸银溶液来检验,通过观察是否有白色沉淀来判断是否存在氯元素 |
| C、摩尔盐制备过程中铁屑要先用碳酸钠溶液浸泡洗涤,使用热的碳酸钠溶液有利提高去油污的能力,最后分离溶液和固体时不可以用倾析法 |
| D、由于苯酚与溴水发生反应时,副反应多,所以只能利用溴水对含苯酚的废水作定性检验,不能用作定量测定 |
研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化.据此判断以下叙述中错误的是( )
| A、金属钠与氯气反应生成氯化钠后,稳定性增强,体系的能量降低 |
| B、物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C、氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很不活泼 |
| D、需加热才能发生的反应一定是吸收能量的反应 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.