题目内容
7.取10g氢气和CH3OH的混合物在氧气中完全燃烧,将其产物和足量的过氧化钠反应,反应后固体的质量增加了( )| A. | 9 g | B. | 10 g | C. | 11 g | D. | 12 g |
分析 氢气燃烧生成水,甲醇燃烧生成二氧化碳与水,燃烧产物通过过量的Na2O2,发生反应:2CO2+2Na2O2=2Na2CO3+O2,过氧化钠增重为CO质量,发生反应2H2O+2Na2O2=4NaOH+O2,过氧化钠增重为H2质量,组成增重质量的组成可以表示为nCO•mH2,即化学式可以改写成nCO•mH2,完全燃烧后过氧化钠增重等于该物质的质量.
解答 解:氢气燃烧生成水,甲醇燃烧生成二氧化碳与水,燃烧产物通过过量的Na2O2,发生反应:2CO2+2Na2O2=2Na2CO3+O2,过氧化钠增重为CO质量,发生反应2H2O+2Na2O2=4NaOH+O2,过氧化钠增重为H2质量,增重质量的组成可以表示为nCO•mH2,CH3OH可以改写为CO•2H2形式,完全燃烧后过氧化钠增重等于氢气与甲醇的质量之和,即过氧化钠增重10g,
故选:B.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,注意利用组成差量法分析解答,难度中等.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 所含质子数和电子数都相同的粒子一定是分子 | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |
15.铁铜单质及其化合物的应用范围很广.现有含氯化亚铁杂质的氯化铜晶体,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达到完全.已知Fe(OH)2的Ksp约为1.0×10-15,则a=9.
(2)加入氧化剂的目的是将Fe2+氧化成Fe3+,X应选择C.
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是CuO[Cu(OH)2、CuCO3、Cu2(OH)2CO3也可以].
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O.简要描述实验步骤应在HCl气流中加热蒸发结晶,过滤、冰水洗涤、低温烘干.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 完全沉淀的pH | 3.2 | a | 6.7 |
(1)化学上通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达到完全.已知Fe(OH)2的Ksp约为1.0×10-15,则a=9.
(2)加入氧化剂的目的是将Fe2+氧化成Fe3+,X应选择C.
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是CuO[Cu(OH)2、CuCO3、Cu2(OH)2CO3也可以].
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O.简要描述实验步骤应在HCl气流中加热蒸发结晶,过滤、冰水洗涤、低温烘干.
2.工业精炼铜的如图所示(如图),下列有关说法正确的是( )
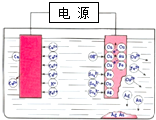

| A. | 右边电极材料为精铜 | |
| B. | 电解质溶液可选择CuSO4溶液 | |
| C. | 随着电解的进行,溶液中Cu2+浓度逐渐增加 | |
| D. | 阳极质量的减小量等于阴极质量的增加量 |
12.下列化学用语表达不正确的是( )
| A. | 乙烯的比例模型: | B. | 丙烷分子的球棍模型: | ||
| C. | 醋酸钠的分子式:CH3COONa | D. | 乙酸的结构简式:CH3COOH |
17.水溶液中的Xn+、Ym+、Zn-三种离子,已知m>n,且X、Y、Z三种原子的M层电子数均为奇数.下列说法中不正确的是( )
| A. | 三种元素的最高正价氧化物的相应水化物之间能两两反应 | |
| B. | Ym+的半径最小 | |
| C. | Y元素一定是金属元素 | |
| D. | 原子半径:Z>X>Y |
