题目内容
16.化学与生产、生活息息相关,下列叙述正确的是( )| A. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| B. | CO2可与H2在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| C. | 泡过高锰酸钾溶液的硅藻土放于新鲜水果箱内是为了催熟水果 | |
| D. | 生活中常用可溶性铝盐和铜盐净水 |
分析 A.燃煤烟气的脱硫为化学变化;
B.二氧化碳转化为燃料和化工原料可以减少二氧化碳的排放;
C.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯能被酸性高锰酸钾氧化;
D.铜为重金属,不能用铜盐净水.
解答 解:A.燃煤烟气中的二氧化硫用碱性溶液吸收,二氧化硫与碱反应生成亚硫酸盐,有新物质生成,属于化学反应,故A错误;
B.二氧化碳转化为燃料和化工原料可以减少二氧化碳的排放,所以二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,可以减少 二氧化碳的排放,符合低碳经济的发展要求,故B正确;
C.乙烯能被酸性高锰酸钾氧化,将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中除去乙烯,从而可延长水果的保鲜期,不是催熟水果,故C错误;
D.可以用可溶性铝盐净水,但铜离子为重金属离子,不能用于净水,故D错误;
故选B.
点评 本题考查常见物质组成、结构与性质的应用,题目难度不大,涉及水的净化、物理变化与化学变化、乙烯性质、环境保护等知识,明确常见元素及其化合物性质即可解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列有机化学反应方程式的书写及反应类型判断都正确的是( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH2Cl2+H2 取代反应 | |
| B. | CH2=CH2+Br2→CH3CHBr2 加成反应 | |
| C. | 2 CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH 加成反应 | |
| D. | CH3COOC2H5+H2O$→_{△}^{浓硫酸}$CH3COOH+C2H5OH 取代反应 |
4.化学与人类生产、生活、科研密切相关,下列有关说法正确的是( )
| A. | 工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应 | |
| C. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| D. | 糖类、蛋白质和油脂都属于营养物质,都能发生水解反应 |
11. 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,电路中转移0.5mol电子则阴离子交换膜上移动0.25mol S2- | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,阴极的电极反应式为MgS+2e-=Mg+S2- | |
| D. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 |
1. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
①可以判断该分解反应已经达到平衡的是BC.(填编号)
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总液度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
5.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 测定等浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH) 和Ka2(H2S)的大小 |
| D | C2H5OH与浓硫酸混合后加热到170°C,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |

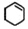 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):



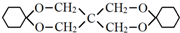 .
. .
.