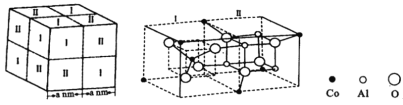
题目内容
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
【答案】 Al(OH)3+OH-=[Al(OH)4]-;H++OH-=H2O;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;CO2+CO32-+H2O=2HCO3-
Al(OH)3+OH-=[Al(OH)4]-;H++OH-=H2O;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;CO2+CO32-+H2O=2HCO3-
【解析】
混合溶液中,加入6 mol氢氧化钠能使1 mol铁离子和1 mol铝离子完全转化为沉淀,再加1 mol氢氧化钠时,氢氧化铝完全溶解生成Na[Al(OH)4],离子反应为Al(OH)3+OH-= [Al(OH)4]-+2H2O;7~8 mol时加氢氧化钠不发生反应,8~9 mol时加盐酸,发生酸碱中和,H++OH-=H2O;9~9.5 mol时通入二氧化碳气体,四羟基合铝酸根离子完全转化为氢氧化铝沉淀,CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;9.5~10 mol继续通入二氧化碳气体,溶液中碳酸根离子转化为碳酸氢根离子,CO2+CO32-+H2O=2 HCO3-,据此分析。
混合溶液中,加入6 mol氢氧化钠能使1 mol铁离子和1 mol铝离子完全转化为沉淀,再加1 mol氢氧化钠时,氢氧化铝完全溶解生成Na[Al(OH)4],离子反应为Al(OH)3+OH-= [Al(OH)4]-+2H2O;7~8 mol时加氢氧化钠不发生反应,8~9 mol时加盐酸,发生酸碱中和,H++OH-=H2O;9~9.5 mol时通入二氧化碳气体,四羟基合铝酸根离子完全转化为氢氧化铝沉淀,CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;9.5~10 mol继续通入二氧化碳气体,溶液中碳酸根离子转化为碳酸氢根离子,CO2+CO32-+H2O=2 HCO3-。
(1)沉淀的量随反应的变化曲线为 ;
;
(2)加入氢氧化钠6 mol及其后发生的各步反应的离子方程式分别为Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-、CO2+CO32-+H2O=2HCO3-。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
. 无论x为何值,两容器中达平衡时w(HI)%均相同
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2