题目内容
7.温度相同、浓度均为0.2mol•L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )| A. | ③①④②⑤ | B. | ③①⑤④② | C. | ③②①⑤④ | D. | ⑤②④①③ |
分析 溶液酸性越强,溶液的pH越小,则溶液的pH:酸性<中性<碱性;先将溶液分为酸性、中性和碱性,然后根据电离程度、盐的水解情况判断各溶液的pH大小.
解答 解:①(NH4)2SO4、④NH4NO3水解呈酸性,两溶液的pH<7;③NH4HSO4电离出H+呈酸性,pH<7;
②NaNO3不水解,其pH=7;
⑤CH3COONa水解呈碱性,pH>7,
①、④比较,前者c(NH4+)大,水解生成c(H+)大,pH小,①③比较,后者电离出c(H+)比前者水解出c(H+)大,pH小,
所以溶液的pH从小到大的顺序为:③①④②⑤,
故选A.
点评 本题考查溶液pH的大小比较,题目难度不大,要考虑盐类的水解程度大小,注意硫酸氢铵中硫酸氢根离子电离出氢离子,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
17.在温度不变的条件下,恒定的容器中进行下列反应:N2O4?2NO2,若N2O4的浓度由0.1mol/L降到0.07mol/L要用10s,那么N2O4的浓度从0.07mol/L降到0.04mol/L时,所用时间( )
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
15.用下列分离装置进行相应实验,能达到相应实验目的是( )
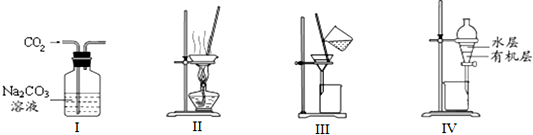

| A. | 用图I除去CO2中含有的少量Cl2 | |
| B. | 用图Ⅱ蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 用图Ⅲ分离NaCl和Na2SO4的混合溶液 | |
| D. | 用图Ⅳ分离CCl4萃取碘水中的碘后已分层的有机层和水层 |
2.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )
| A. |  用如图所示装置制取少量H2 | |
| B. |  用如图所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. |  用如图所示装置制取少量Cl2 | |
| D. |  用如图所示装置确定导线中有电流通过及并确定电流方向 |
12.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是( )
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生灰绿色沉淀,最后呈红褐色 | |
| D. | 只需滴加KSCN溶液 |
19.图是某有机物的1H核磁共振谱图,则该有机物可能是( )
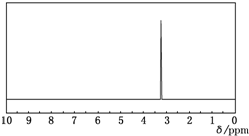

| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3-O-CH3 | D. | CH3CHO |
17.下列化学用语的书写,正确的是( )
| A. | 氮气的电子式: | B. | 溴化钠的电子式: | ||
| C. | 乙醛的结构简式:CH2COH | D. | 次氯酸的化学式:HClO |
 .
.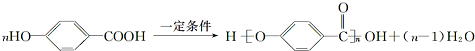 .
.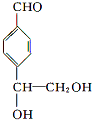 等.
等.