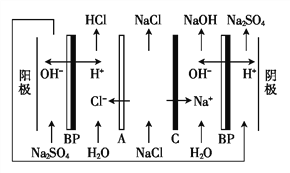
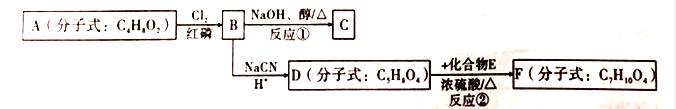
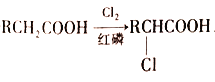题目内容
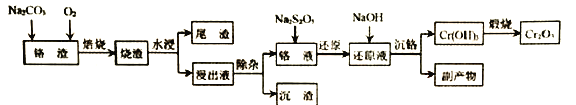
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp [Cr(OH)3]=6.4×10-31
(1)若以氧化物形式表示矿物的组成,Fe2SiO4可表示为______。
(2)焙烧时通入氧气的作用是 ______。
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43- 、AsO43- 、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。
①反应过程控制溶液pH为9,若pH>9除杂率降低的原因是 ______。
②反应的温度控制在80℃左右,温度不宜太高的主要原因是_______。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)
①完成“还原”反应的离子方程式:_____________
![]()
②已知铬液中c(Cr2O72- )=0.32 mol/L ,为了不使还原过程产生Cr(OH)3沉淀,应 控制反应过程pH不大于 _____。
(5)“沉铬”主要副产物为______。
【答案】 2FeO·SiO2 将Cr2O3、FeO氧化 pH过高时,Mg2+、NH4+易转化为Mg(OH)2、NH3,影响沉淀形成。 铵盐受热分解 2、3、10H+、4、6、5H2O 4 Na2SO4
【解析】(1). Fe2SiO4中的Fe元素为+2价,以氧化物的形式可表示为:2FeO·SiO2,故答案为:2FeO·SiO2;
(2). 由焙烧后的工艺流程可知,在焙烧时通入氧气的目的是将Cr2O3、FeO氧化,故答案为:将Cr2O3、FeO氧化;
(3). ①.“除杂”时加入MgSO4-(NH4)2SO4混合物的目的是与溶液中少量的PO43-、AsO43-、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去,反应过程中需控制溶液pH为9,若pH>9,则Mg2+、NH4+易转化为Mg(OH)2、NH3,影响沉淀形成,使除杂率降低,故答案为:Mg2+、NH4+易转化为Mg(OH)2、NH3,影响沉淀形成;
②. 反应的温度控制在80℃左右,若温度太高,会使铵盐受热分解,降低除杂率,故答案为:铵盐受热分解;
(4). ①.在酸性条件下,Cr2O72-与S2O52-发生氧化还原反应生成Cr3+和SO42-,根据得失电子守恒和原子守恒,配平后的离子方程式为:2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O,故答案为:2、3、10H+、4、6、5H2O;
②. 铬液中c(Cr2O72- )=0.32 mol/L,由2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O可知,反应后的溶液中c(Cr3+ )=0.64mol/L,当Cr3+开始生成Cr(OH)3沉淀时,溶液中的c3(OH-)=![]() ,解得c(OH-)=10-10mol/L,溶液的pH等于4,所以为了不使还原过程产生Cr(OH)3沉淀,应控制反应过程pH不大于4,故答案为:4;
,解得c(OH-)=10-10mol/L,溶液的pH等于4,所以为了不使还原过程产生Cr(OH)3沉淀,应控制反应过程pH不大于4,故答案为:4;
(5). 由工艺流程图和反应2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O可知,“沉铬”的主要副产物为Na2SO4,故答案为:Na2SO4。