��Ŀ����
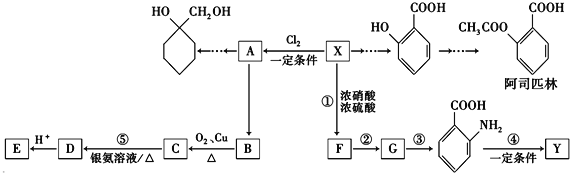
����Ŀ��ijС��ͬѧ������ͼװ�ÿ�չʵ�飬��ش�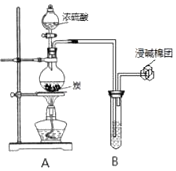
��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ �� ��B��ʢװ������ɫʯ����Һ����B�й۲쵽�������� ��
��2����B��ʢװ������������������Һ����B�й۲쵽�������� ��
��3����B��ʢװ��������������ˮ����B�й۲쵽�������� �� B�з�������Ҫ��Ӧ�����ӷ���ʽΪ �� ��B��ʢװ��������H2O2��ˮ��Һ����B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��4����B��ʢװ��������Ʒ����Һ����B�й۲쵽�������� ��
���𰸡�
��1��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O,��ɫʯ����Һ���
CO2��+2SO2��+2H2O,��ɫʯ����Һ���
��2���а�ɫ��������
��3������ɫ��ȥ,Cl2+SO2+2H2O=4H++2Cl��+SO42,SO2+H2O2=H2SO4
��4����ɫ��ȥ
���������⣺��1��̿��Ũ������ȣ���Ӧ���ɶ�����������̼��ˮ������������ˮ��Ӧ���������������������̼������������Ӧ���������ᱵ��̼�ᱵ��������3��������ˮ��dz����ɫ������������л�ԭ�ԣ�����������ˮ��Ӧ������������ᣬ����������������ⷴӦ���������4�������������Ư���ԡ�
��������1��̿��Ũ������ȣ���Ӧ���ɶ�����������̼��ˮ��A�з�Ӧ�ķ���ʽΪC+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O������������ˮ��Ӧ���������ᣬ����B����ɫʯ����Һ��죻������������̼������������Ӧ���������ᱵ��̼�ᱵ������������B��ʢװ������������������Һ����B�й۲쵽���������а�ɫ�������ɣ�3��������ˮ��dz����ɫ������������л�ԭ�ԣ�����������ˮ��Ӧ������������ᣬ������������ˮ����ɫ��ȥ����������Ҫ��Ӧ�����ӷ���ʽΪCl2+SO2+2H2O=4H++2Cl��+SO42-������������������ⷴӦ�������ᣬ������Ӧ�Ļ�ѧ����ʽΪSO2+H2O2=H2SO4����4�������������Ư���ԣ���ʹƷ����Һ��ɫ������B�й۲쵽�������Ǻ�ɫ��ȥ��
CO2��+2SO2��+2H2O������������ˮ��Ӧ���������ᣬ����B����ɫʯ����Һ��죻������������̼������������Ӧ���������ᱵ��̼�ᱵ������������B��ʢװ������������������Һ����B�й۲쵽���������а�ɫ�������ɣ�3��������ˮ��dz����ɫ������������л�ԭ�ԣ�����������ˮ��Ӧ������������ᣬ������������ˮ����ɫ��ȥ����������Ҫ��Ӧ�����ӷ���ʽΪCl2+SO2+2H2O=4H++2Cl��+SO42-������������������ⷴӦ�������ᣬ������Ӧ�Ļ�ѧ����ʽΪSO2+H2O2=H2SO4����4�������������Ư���ԣ���ʹƷ����Һ��ɫ������B�й۲쵽�������Ǻ�ɫ��ȥ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ʯ�е�̼���ƺ�ˮ����ȫ��Ӧ��CaC2+2H2O�TC2H2��+Ca��OH��2ʹ��Ӧ������������ˮ�������ų�ˮ��������ɼ������״����Ȳ��������Ӷ��ɲⶨ��ʯ��̼���Ƶĺ�����
��1���������������͵�����װʵ��װ�ã�
��� | 1 | 2 | 3 | 4 | 5 | 6 |
���ܼ����� |
|
|
|
|
|
|
ÿ����Ƥ���϶����������� | ||||||
����������������������ʱ�����������͵��ܴ�����ֱ�����ӵ�˳��������������ܵ���ţ��ǣ����������� ��
��2���������Ӻú���ʵ��ʱ�������в�����ÿ�����ֻ����һ�Σ���
�ٳ�ȡһ������ʯ����������3�У�������Ƥ����
�ڼ��װ�õ������ԣ�
��������6��5��ע������ˮ��
�ܴ�����3�ָ�������ʱ����ȡ����4��ˮ�����������2�е�ˮ���Բ��ƣ���
��������������6�Ļ�����ʹˮ��ε��£�������������ʱ���رջ�����
��ȷ�IJ���˳���ò��������д���� ��
��3����ʵ����������������ŵ���ζ���Ҳⶨ���ƫ��������Ϊ��ʯ�к������ʣ�
��4����ʵ��ʱ��ȡ�ĵ�ʯ1.60g�������ų�ˮ�����������ɱ�״����Ȳ�����Ϊ448mL���˵�ʯ��̼���Ƶ����������� %��
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2 ��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ����
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ����
��3������Һ����SO2�Ĺ����У�pH��n��SO32������n��HSO3�����仯��ϵ�����
n��SO32������n��HSO3���� | 91��9 | 1��1 | 9��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��ж�NaHSO3��Һ���ԣ��û�ѧƽ��ԭ��������
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ���ǣ�ѡ����ĸ������
a��c��Na+��=2c��SO32����+c��HSO3����
b��c��Na+����c��HSO3������c��SO32������c��H+��=c��OH����
c��c��Na+��+c��H+��=c��SO32����+c��HSO3����+c��OH����
��4��������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£� 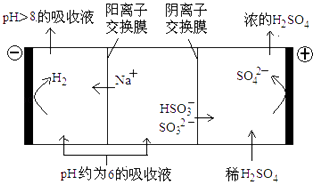
��HSO3���������ŵ�ĵ缫��Ӧʽ����
�ڵ�����������ҺPH����8����ʱ������Һ������ѭ�����ã���������ԭ�� ��