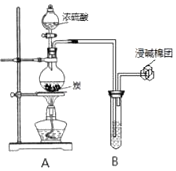
��Ŀ����
����Ŀ����ʯ�е�̼���ƺ�ˮ����ȫ��Ӧ��CaC2+2H2O�TC2H2��+Ca��OH��2ʹ��Ӧ������������ˮ�������ų�ˮ��������ɼ������״����Ȳ��������Ӷ��ɲⶨ��ʯ��̼���Ƶĺ�����
��1���������������͵�����װʵ��װ�ã�
��� | 1 | 2 | 3 | 4 | 5 | 6 |
���ܼ����� |
|
|
|
|
|
|
ÿ����Ƥ���϶����������� | ||||||
����������������������ʱ�����������͵��ܴ�����ֱ�����ӵ�˳��������������ܵ���ţ��ǣ����������� ��
��2���������Ӻú���ʵ��ʱ�������в�����ÿ�����ֻ����һ�Σ���
�ٳ�ȡһ������ʯ����������3�У�������Ƥ����
�ڼ��װ�õ������ԣ�
��������6��5��ע������ˮ��
�ܴ�����3�ָ�������ʱ����ȡ����4��ˮ�����������2�е�ˮ���Բ��ƣ���
��������������6�Ļ�����ʹˮ��ε��£�������������ʱ���رջ�����
��ȷ�IJ���˳���ò��������д���� ��
��3����ʵ����������������ŵ���ζ���Ҳⶨ���ƫ��������Ϊ��ʯ�к������ʣ�
��4����ʵ��ʱ��ȡ�ĵ�ʯ1.60g�������ų�ˮ�����������ɱ�״����Ȳ�����Ϊ448mL���˵�ʯ��̼���Ƶ����������� %��
���𰸡�
��1��6��3��1��5��2��4
��2���ڢ٢ۢݢ�
��3��CaS��Ca3P2
��4��80
���������⣺��1����ʵ������������˳��Ӧ���շ���װ�ã�3��6������ˮװ�ã�5���ͽ���װ�ã�4�����ӣ�����ʱҪ������ˮƿ����5���е���������Ӧ�̽�����������˳��Ϊ��6��3��1��5��2��4�����Դ��ǣ�6��3��1��5��2��4��
��2�����ռ��������ԡ�װҩƷ��������Ӧ����ȡ����IJ������������ҩƷʱӦ�ȼӹ����ټ�Һ�壬���Դ��ǣ��ڢ٢ۢݢܣ�
��3����ʯ�к�������������ˮ��Ӧ���ɳ�������ζ������������������壬��ʯ�к��п���ˮ��Ӧ���������CaS��Ca3P2�����Դ��ǣ�CaS��Ca3P2��
��4�����ݷ���ʽ���㣺
CaC2 | + | H2O | �T | C2H2�� | + | Ca��OH��2 |
64g | 22.4L | |||||
m | 448��10��3L |
m= ![]() =1.28g���Ե�ʯ��̼���Ƶİٷֺ�����
=1.28g���Ե�ʯ��̼���Ƶİٷֺ����� ![]() ��100%=80%�����Դ��ǣ�80��
��100%=80%�����Դ��ǣ�80��