题目内容
18.下列有机物同分异构体数目判断错误的是( )| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H10O2的酯 | 10 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C8H10的芳香烃 | 4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5;
B.能使溴的四氯化碳溶液褪色,说明为戊烯;
C.能与Na反应生成氢气,说明为醇类,依据丁基的个数判断;
D.分子式为C8H10的芳香烃可为乙苯或二甲苯.
解答 解:A.若为甲酸和丁醇酯化,丁醇有4种,形成的酯有四个:
HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
若为乙酸和丙醇酯化,丙醇有2种,形成的酯有2个:CH3COOCH2CH2CH3、CH3COOCH(CH3)2;
若为丙酸和乙醇酯化,丙酸有1种,形成的酯有1个:CH3CH2COOCH2CH3;
若为丁酸和甲醇酯化,丁酸有2中,形成的酯有2个:CH3CH2CH2COOCH3、(CH3)2CHCOOCH3.
故有9种,故A错误;
B.能使溴的四氯化碳溶液褪色,说明为戊烯,分别为1-戊烯、2-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯、3-甲基-1-丁烯,故总共有5种,故B正确;
C.能与Na反应生成氢气,说明为醇类,C4H10O可写成C4H9OH,丁基的个数为4,故总共应有4种醇,故C正确;
D.分子式为C8H10的芳香烃可为乙苯或二甲苯,二甲苯有邻、间、对3种同分异构体,共4种,故D正确.
故选A.
点评 本题主要考查的是同分异构体数目的判断,为高频考点,侧重考查学生的分析能力,掌握碳原子数小于5的烷烃基的个数是解决本题的关键,难度不大,甲基和乙基各1个,丙基2个,丁基4个,戊基8个,答题时注意思维要缜密,避免漏写的情况.

练习册系列答案
相关题目
8.下表所列为五种短周期元素的相关信息:
回答下列问题:
(1)C元素在元素周期表中的位置为第二周期,第ⅤA族;
(2)B、D、E元素原子半径由大到小的顺序为Na>Al>Cl(填元素符号);
(3)A元素最高价氧化物的电子式为 ,含有的化学键类型为共价键;
,含有的化学键类型为共价键;
(4)工业上冶炼E的化学方程式为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(5)下列说法正确的是AD(填选项字母).
A.简单氢化物稳定性:D>A B.最高价氧化物对应水化物的酸性:A>C
C.单质的还原性:E>B D.对应离子的氧化性:E>B.
| 元素 | 元素的相关信息 |
| A | A元素存在多种同素异形体,其中一种常用电极导电材料 |
| B | 短同期中金属性最强 |
| C | 单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| E | 地壳中含量最多的金属 |
(1)C元素在元素周期表中的位置为第二周期,第ⅤA族;
(2)B、D、E元素原子半径由大到小的顺序为Na>Al>Cl(填元素符号);
(3)A元素最高价氧化物的电子式为
 ,含有的化学键类型为共价键;
,含有的化学键类型为共价键;(4)工业上冶炼E的化学方程式为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(5)下列说法正确的是AD(填选项字母).
A.简单氢化物稳定性:D>A B.最高价氧化物对应水化物的酸性:A>C
C.单质的还原性:E>B D.对应离子的氧化性:E>B.
9.某物质的实验式为PtCl4•2NH3,其水溶液不导电.加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | 配合物中中心原子的电荷数为6 | B. | 该配合物可能是平面正方形结构 | ||
| C. | Cl-和NH3分子均与Pt4+形成配位 | D. | 该配合物的配体只有NH3 |
6.湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质.一种由铜镉渣生产金属镉的流程如图:
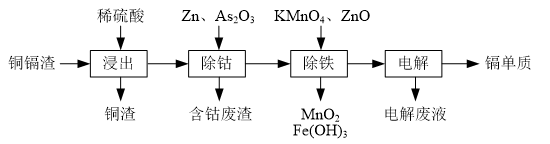
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是2Cu+4H++O2=2Cu2++2H2O.
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3.该微电池的正极反应式为As2O3+12H++12e-=2AsH3+3H2O.
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH.
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=1:3.
②除铁时加入ZnO控制反应液pH的范围为3.3~7.2.
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余.请设计实验方案加以验证:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4.

表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3.该微电池的正极反应式为As2O3+12H++12e-=2AsH3+3H2O.
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH.
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=1:3.
②除铁时加入ZnO控制反应液pH的范围为3.3~7.2.
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余.请设计实验方案加以验证:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4.
13.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到.现用铜片、石墨作电极,电解KI溶液制取CuI.为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液.电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝.下列说法正确的是( )
| A. | 铜片做阴极,石墨做阳极 | |
| B. | 白色沉淀在阴极附近生成 | |
| C. | 阳极区溶液变蓝的原因是:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 | |
| D. | 阳极区溶液变蓝的原因是:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
3.下列过程既是放热过程又是体系混乱度增加过程的是( )
| A. | 2H2(g)+O2(g)═2H2O(l) | |
| B. | 4Al(s)+3O2(g)═2Al2O3(s) | |
| C. | 2Na(s)+2H2O(l)═2Na+(aq)+2OH- (aq)+H2(g) | |
| D. | 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH- (aq)═BaSO4(s)+2H2O(l) |
10.下列分子中含手性碳原子的是( )
| A. |  | B. | CH3-CH2-CH3 | C. | CH3-CH2-CH2-OH | D. |  |
7.某元素的原子核外有3个电子层,最外层有7个电子,该原子核内的质子数为( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
 ,其化学键属极性共价键(填“极性”或“非极性”).
,其化学键属极性共价键(填“极性”或“非极性”).