��Ŀ����
����ͼ��ʾ����һ�ݻ�Ϊ300 mL��ע��������500 mL��������ƿ��������ƿ����0.384 g Cu.������ƿ�м���18 mL 2.5 mol��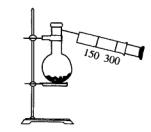
��1�������Cu��ϡ����ķ�Ӧ���ʣ����Բ��ö��ֲ�ͬ�Ĵ�ʩ��
���������ü��뻯ѧ�Լ��ķ��������Լ���________.
����A.ˮ
����B.��ˮ����
����C.��˿
����D.����п
�������������¶ȵķ���������Ҫ��������________.
��2��������������ס��ԭ����_______________.
��3����Ӧ��ʼ����ƿ�п��Թ۲쵽��������
����_____________________________.
����_____________________________.
����_____________________________.
��4��ֹͣ��Ӧ����������ע����������ʹ���������壬Һ���������ַ�Ӧ.������Һ������ı仯��������Һ�е���������ʵ���Ũ���뿪ʼ���________.
����A.����
����B.���
����C.��С
����D.��ȷ��
�𰸣���1����B���ھƾ���;��2����ֹ���������ḯʴ����3����ͭƬ�����������ݳ��������ܽ⣻����Һ��ɫ��������������ɺ���ɫ����4��A
��ʾ��
��ʾ��
| ��Ӧ��
|

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ




 2NH3(g) ��H <0
2NH3(g) ��H <0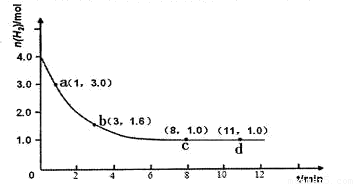
 CO+H2����CO+H2O(g)
CO+H2����CO+H2O(g)  2C(g).��Ӧ��ʼʱ�ɻ����Ļ�����λ�����ͼ��ʾ������Ӧ�ﵽƽ��ʱ������λ������ͼ��ʾ���ﵽƽ��ʱ��A��ת����Ϊ
���������µķ�Ӧ��ƽ�ⳣ��Ϊ
��
2C(g).��Ӧ��ʼʱ�ɻ����Ļ�����λ�����ͼ��ʾ������Ӧ�ﵽƽ��ʱ������λ������ͼ��ʾ���ﵽƽ��ʱ��A��ת����Ϊ
���������µķ�Ӧ��ƽ�ⳣ��Ϊ
��