题目内容
(2011?南京一模)以天然气为原料经由合成气(C0、H2)制化学品是目前天然气转化利用的主导技术路线. 以甲烷的部分氧化为基础制备甲醚(CH3OCH3)和甲醇的工业流程如下:

(1)甲烷的部分氧化反应如下:
2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71.2kJ?mol-1
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ?mol-1
则△H2=
(2)催化反应室1中合成甲醚的反应为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H
(3)催化反应室2中发生如下反应:CO(g)+2H2(g)═CH30H(g)△H<0
在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器分别充入a mol C0和2a mol H2,三个容器的反应 温度分别为T1、T2、T3且恒定不变,在其他条件相同情况下.实验测得反应均进行到t min 时CO 的体积分数如下图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是

(4)如下图为熔融碳酸盐燃料电池的工作原理示意图. 熔融碳酸盐燃料电池的正极反应可表示为:


(1)甲烷的部分氧化反应如下:
2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71.2kJ?mol-1
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ?mol-1
则△H2=
+247.3kJ?mol-1
+247.3kJ?mol-1
.(2)催化反应室1中合成甲醚的反应为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H
<
<
0 (填“<”、“>”或“=”)(3)催化反应室2中发生如下反应:CO(g)+2H2(g)═CH30H(g)△H<0
在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器分别充入a mol C0和2a mol H2,三个容器的反应 温度分别为T1、T2、T3且恒定不变,在其他条件相同情况下.实验测得反应均进行到t min 时CO 的体积分数如下图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
Ⅲ
Ⅲ
;都达到化学平衡状态时,C0转化率最小的是Ⅲ
Ⅲ
.
(4)如下图为熔融碳酸盐燃料电池的工作原理示意图. 熔融碳酸盐燃料电池的正极反应可表示为:
O2+4e-+2CO2═2CO32-
O2+4e-+2CO2═2CO32-
.
分析:(1)根据盖斯定律
×(①+②+③×2)得2CH4(g)+O2(g)═2CO(g)+4H2(g),据此计算△H2;
(2)该反应为熵值减小的反应,根据△G=△H-T△S,△G<0反应自发进行,据此判断;
(3)该反应正反应是放热反应,平衡时升高温度平衡向逆反应移动,CO的体积分数增大,根据温度与体积分数的关系判断是否处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,温度越高,平衡时CO的转化率越低;
(4)电池的工作原理示意图可知,氧气在正极放电,在二氧化碳条件下,反应生成碳酸根.
| 1 |
| 2 |
(2)该反应为熵值减小的反应,根据△G=△H-T△S,△G<0反应自发进行,据此判断;
(3)该反应正反应是放热反应,平衡时升高温度平衡向逆反应移动,CO的体积分数增大,根据温度与体积分数的关系判断是否处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,温度越高,平衡时CO的转化率越低;
(4)电池的工作原理示意图可知,氧气在正极放电,在二氧化碳条件下,反应生成碳酸根.
解答:解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H1=-890.3kJ?mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ?mol-1
根据盖斯定律
×(①+②+③×2)得2CH4(g)+O2(g)═2CO(g)+4H2(g),
故
×(△H1+△H2+△H3)=-71.2kJ?mol-1,
所以
×(-890.3kJ?mol-1+△H2+2×250.3kJ?mol-1)=-71.2kJ?mol-1,
解得△H2=+247.3kJ?mol-1,
故答案为:+247.3kJ?mol-1;
(2)该反应为熵值减小的反应,△G=△H-T△S,△G<0反应自发进行,故△H<0,
故答案为:<;
(3)该反应正反应是放热反应,平衡时升高温度平衡向逆反应移动,CO的体积分数增大,由图可知温度T2>T1,体积分数φ(Ⅰ)>φ(Ⅱ),故Ⅰ未到达平衡.T3>T2,体积分数φ(Ⅲ)>φ(Ⅱ),故Ⅲ处于平衡状态,容器Ⅱ不能确定是否处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,温度越高,平衡时CO的转化率越低,故Ⅲ的转化率最低,
故答案为:Ⅲ;Ⅲ;
(4)氧气在正极放电,在二氧化碳条件下,反生成碳酸根,正极反应式为:O2+4e-+2CO2═2CO32-,
故答案为:O2+4e-+2CO2═2CO32-.
②CH4(g)+CO2(g)═2CO(g)+2H2(g);△H2
③CH4(g)+H2O(g)═CO(g)+3H2(g);△H3=+250.3kJ?mol-1
根据盖斯定律
| 1 |
| 2 |
故
| 1 |
| 2 |
所以
| 1 |
| 2 |
解得△H2=+247.3kJ?mol-1,
故答案为:+247.3kJ?mol-1;
(2)该反应为熵值减小的反应,△G=△H-T△S,△G<0反应自发进行,故△H<0,
故答案为:<;
(3)该反应正反应是放热反应,平衡时升高温度平衡向逆反应移动,CO的体积分数增大,由图可知温度T2>T1,体积分数φ(Ⅰ)>φ(Ⅱ),故Ⅰ未到达平衡.T3>T2,体积分数φ(Ⅲ)>φ(Ⅱ),故Ⅲ处于平衡状态,容器Ⅱ不能确定是否处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,温度越高,平衡时CO的转化率越低,故Ⅲ的转化率最低,
故答案为:Ⅲ;Ⅲ;
(4)氧气在正极放电,在二氧化碳条件下,反生成碳酸根,正极反应式为:O2+4e-+2CO2═2CO32-,
故答案为:O2+4e-+2CO2═2CO32-.
点评:本题考查根据盖斯定律进行反应热的计算、反应方向的判断、化学平衡图象与影响因素、原电池原理等,难度中等,(3)中注意根据温度与体积分数判断是否处于平衡状态,本质是温度对化学平衡的影响.

练习册系列答案
相关题目
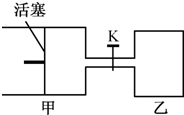 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( ) 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂