题目内容
16.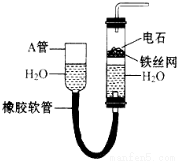 如图装置可以制取乙炔,请填空:
如图装置可以制取乙炔,请填空:(1)图中A管的作用是调节水面高度以控制反应的发生和停止,制取乙炔的化学方程式CaC2+2H2O→C2H2↑+Ca(OH)2,为了避免反应太迅速,可采取的措施是用饱和食盐水代替水.;
(2)若实验产生的气体有难闻的气味,这是因为乙炔中混有硫化氢气体,除去并检验该气体用硫酸铜溶液;
(3)乙炔通入溴水中观察到的现象为溴水褪色;
(4)为了安全,点燃乙炔前应验纯,乙炔燃烧的实验现象是火焰明亮伴有浓烈的黑烟.
分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔,该反应非常剧烈,反应速率很快;
(2)制备的乙炔中含有硫化氢,硫化氢具有臭鸡蛋气味,能够与硫酸铜反应;
(3)乙炔含有碳碳三键能够与溴水发生加成反应;
(4)可燃气体在燃烧前都应进行纯度检验,否则容易发生爆炸;乙炔含碳量高,燃烧火焰明亮,有黑烟.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,反应非常剧烈,为减缓反应速率,通常用饱和食盐水代替水;
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;用饱和食盐水代替水;
(2)制备的乙炔中含有硫化氢,硫化氢具有臭鸡蛋气味,能够与硫酸铜反应,可以用硫酸铜除去硫化氢;
故答案为:硫化氢;硫酸铜;
(3)乙炔含有碳碳三键能够与溴水发生加成反应,现象为:溴水褪色;
故答案为:溶液褪色;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟;
故答案为:验纯;火焰明亮伴有浓烈的黑烟.
点评 本题考查乙炔的实验室制法和性质的检验,熟悉制备原理和反应特点是解题关键,侧重考查学生对基础知识掌握的熟练程度.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
7.下列关于阿伏伽德罗常数(NA)的说法正确的是( )
| A. | 32gO2 所含的原子数目为NA | |
| B. | 0.5 molH2O含有的原子数目为0.5 NA | |
| C. | 1mol H2 含有的氢分子数目为2 NA | |
| D. | 0.5 NA 个氧气分子的物质的量为0.5 mol |
4.下列实验事故处理的方法中,正确的是( )
| A. | 不慎把较多浓硫酸沾在手上,立即用大量水冲洗后再涂抹NaHCO3溶液 | |
| B. | 不慎将浓碱液沾到皮肤上,应立即用大量水冲洗,然后涂抹盐酸溶液 | |
| C. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布盖灭 |
1.一定温度下的密闭容器中发生可逆反应2SO2(g)+O2(g)?2SO3(g),不能说明该反应一定达到平衡状态的是( )
| A. | SO2的百分含量保持不变 | |
| B. | SO2和SO3的生成速率相等 | |
| C. | 密闭容器中的压强保持不变 | |
| D. | SO2、O2、SO3的物质的量之比为2:1:2 |
8.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)═c(A-)+c(Cl-) | |
| D. | 在25℃100 mL NH4Cl溶液中:c(Cl-)═c(NH4+)+c(NH3•H2O) |
5.钢化玻璃的重要用途之一是制造汽车车窗,钢化玻璃是将普通玻璃加热到一定温度后急骤冷却制成的.钢化玻璃的主要原料是( )
| A. | 纯碱、石灰石、石英、铁屑 | B. | 纯碱、石灰石、石英 | ||
| C. | 碳酸钾、石灰石、石英 | D. | 水玻璃、石灰石、石英、氧化铝 |