题目内容
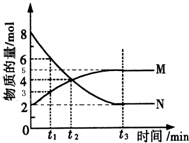 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:(1)比较t2时刻,正逆反应速率大小V正
(2)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:
(3)t3时刻化学反应达到平衡时反应物的转化率为
(4)如果升高温度则V逆
考点:化学平衡建立的过程
专题:化学平衡专题
分析:(1)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,据此答题;
(2)根据v=
计算反应速率;
(3)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=
×100%计算;
(4)升高温度反应速率增大,据此答题;
(2)根据v=
| △c |
| t |
(3)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=
| 已转化的物质的量 |
| 起始物质的量 |
(4)升高温度反应速率增大,据此答题;
解答:
解:(1)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,故答案为:>;
(2)根据v=
计算得M的平均化学反应速率为
mol/(L?min)=0.25mol/(L?min),故答案为:0.25mol/(L?min);
(3)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=
×100%计算得N的转化率为
×100%=75%,故答案为:75%;
(4)升高温度可逆反应中的正逆反应速率都增大,故答案为:增大;
(2)根据v=
| △c |
| t |
| ||
| 2 |
(3)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=
| 已转化的物质的量 |
| 起始物质的量 |
| 8-2 |
| 8 |
(4)升高温度可逆反应中的正逆反应速率都增大,故答案为:增大;
点评:本题主要考查了化学反应速率的计算、转化率的计算、影响化学反应速率的因素等知识点,难度不大,解题时注意基础知识的灵活运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关物质的性质、制取或应用等的说法中正确的是( )
| A、用10%的盐酸蒸发浓缩获得30%的盐酸 |
| B、可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
| C、二氧化硫具有漂白性,与氯水混合使用效果更好 |
| D、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
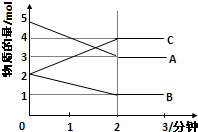 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
 在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O42NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O42NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)