题目内容
 某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:
某化学兴趣小组的同学为测定石灰石样品中碳酸钙的含量(杂质不溶于水也不溶于酸),同学们取石灰石样品16克,放入68.4克盐酸中,测得物质总质量的变化如图所示,求:(1)原混合物中碳酸钙的含量;
(2)反应后所得溶液中溶质的质量分数.
考点:化学方程式的有关计算
专题:计算题
分析:(1)因为碳酸钙和盐酸反应后会产生二氧化碳气体,所以烧杯中物质总质量会减少,根据质量守恒定律可知,烧杯中物质总质量的减少量就是生成的二氧化碳的质量,根据化学方程式利用二氧化碳的质量可得到碳酸钙的质量;
(2)根据碳酸钙和盐酸反应的化学方程式,利用二氧化碳的质量可求出生成的氯化钙的质量,进而求出氯化钙的质量分数,其中反应后溶液的质量=参加反应的固体质量+液体质量-生成的沉淀质量-生成的气体质量.
(2)根据碳酸钙和盐酸反应的化学方程式,利用二氧化碳的质量可求出生成的氯化钙的质量,进而求出氯化钙的质量分数,其中反应后溶液的质量=参加反应的固体质量+液体质量-生成的沉淀质量-生成的气体质量.
解答:
解:(1)通过图象可知,反应产生的二氧化碳的质量为:84.4g-80g=4.4g
设原混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
=
,x=10g,
答:原混合物中碳酸钙的含量是10g;
(2)设反应产生的CaCl2的质量为y
=
y=11.1g
反应后溶液质量=10g+68.4g-4.4g=74g
所以反应后CaCl2的质量分数为:
×100%=15%
答:反应后所得溶液中溶质的质量分数是15%.
设原混合物中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
| 10 |
| 44 |
| x |
| 4.4 |
答:原混合物中碳酸钙的含量是10g;
(2)设反应产生的CaCl2的质量为y
| 111 |
| y |
| 44 |
| 4.4 |
反应后溶液质量=10g+68.4g-4.4g=74g
所以反应后CaCl2的质量分数为:
| 11.1g |
| 74g |
答:反应后所得溶液中溶质的质量分数是15%.
点评:此题是和图象相结合的化学方程式的计算题,此题要分析清题意,看懂图象并利用图象中给出的数据来做题,另外要掌握质量分数的公式,难度适中.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
为鉴别K2CO3和NaHCO3两种白色固体,有四名同学分别设计了下列四种不同的方法,其中不可行的是( )
| A、分别滴加0.1 mol?L-1的盐酸,看气泡产生的快慢 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色沉淀生成 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,做焰色反应实验,观察火焰的颜色 |
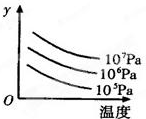 有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A、a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B、a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C、Q>0时,y轴表示达到平衡时B的转化率 |
| D、Q<0时,y轴表示达到平衡时A的浓度 |
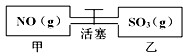 如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )
如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )| A、气体的密度 |
| B、气体分子数 |
| C、气体压强 |
| D、气体平均摩尔质量 |
某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低.该学生找出以下原因,其中不会使溶液浓度偏低的是( )
| A、容量瓶刚用蒸馏水洗净,没有烘干 |
| B、没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 |
| C、定容时滴加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 |
| D、定容时仰视刻度线 |

 (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是