题目内容
下列有关二氧化硫的实验现象和说法都正确的是( )
| A、能使湿润的蓝色石蕊试纸先变红后褪色 |
| B、使沾有酸性高锰酸钾溶液的滤纸褪色,证明了二氧化硫的漂白性 |
| C、使品红试纸褪色,证明了二氧化硫的漂白性 |
| D、沾有酚酞和NaOH 溶液的滤纸褪色,证明了二氧化硫具有漂白性 |
考点:二氧化硫的化学性质
专题:氧族元素
分析:A.二氧化硫为酸性氧化物,不能使试纸褪色;
B.二氧化硫与高锰酸钾发生氧化还原反应;
C.二氧化硫具有漂白性,能使品红褪色;
D.二氧化硫为酸性氧化物,与碱反应生成盐和水.
B.二氧化硫与高锰酸钾发生氧化还原反应;
C.二氧化硫具有漂白性,能使品红褪色;
D.二氧化硫为酸性氧化物,与碱反应生成盐和水.
解答:
解:A.二氧化硫为酸性氧化物,能使湿润的蓝色石蕊试纸变红,故A错误;
B.二氧化硫与高锰酸钾发生氧化还原反应,S元素的化合价升高,体现二氧化硫的还原性,故B错误;
C.二氧化硫能使品红褪色,体现其具有漂白性,故C正确;
D.沾有酚酞和NaOH 溶液的滤纸变红色,二氧化硫与NaOH反应生成盐和水,碱性降低,滤纸褪色,体现二氧化硫酸性氧化物的性质,故D错误;
故选C.
B.二氧化硫与高锰酸钾发生氧化还原反应,S元素的化合价升高,体现二氧化硫的还原性,故B错误;
C.二氧化硫能使品红褪色,体现其具有漂白性,故C正确;
D.沾有酚酞和NaOH 溶液的滤纸变红色,二氧化硫与NaOH反应生成盐和水,碱性降低,滤纸褪色,体现二氧化硫酸性氧化物的性质,故D错误;
故选C.
点评:本题考查二氧化硫的化学性质,为高频考点,把握二氧化硫的还原性、漂白性、酸性氧化物性质为解答的关键,注意分析发生的反应及现象,题目难度不大.

练习册系列答案
相关题目
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):
请计算H2(g)+Cl2(g)═2HCl(g)的反应热( )
| 化学键 | H-H | Cl-Cl | Cl-H |
| 键能/(kJ?mol-1) | 436 | 243 | 431 |
| A、+862 kJ?mol-1 |
| B、+679 kJ?mol-1 |
| C、-183 kJ?mol-1 |
| D、+183 kJ?mol-1 |
卤代烃在强碱的醇溶液中发生消去反应时,醇的主要作用是( )
| A、催化剂 | B、氧化剂 |
| C、还原剂 | D、溶剂 |
下列反应中,不属于氧化---还原反应的是( )
A、C+O2
| ||||
B、CH4+2O2
| ||||
| C、CaO+H2O=Ca(OH)2 | ||||
D、CuO+H2
|
在主要含有K+、Cl-、AlO2-、CO32-的溶液中逐滴加入盐酸至过量过程中,与H+反应的粒子有①AlO2-②Al(OH)3③CO32-④HCO3-,请分析它们反应的顺序为( )
| A、①②③④ | B、③④①② |
| C、①③④② | D、①③②④ |
 如图装置,已知两电极上发生的电极反应分别为:
如图装置,已知两电极上发生的电极反应分别为: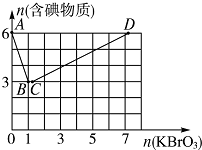 现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题: