题目内容
20.下列说法正确的是( )| A. | H2SO4电离方程式H2SO4=2H++S6++4O2- | |
| B. | H2、D2、T2互为同位素 | |
| C. | 18g H2O含有的电子数为10NA | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
分析 A.硫酸根为原子团,不能拆;
B.同位素研究对象为核素;
C.质量转化为物质的量,结合1个水分子含有10个电子;
D.依据原子中质子数等于电子数;质量数=质子数+中子数解答.
解答 解:A.硫酸为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,故A错误;
B.H2、D2、T2是单质,不是核素,故B错误;
C.18g H2O物质的量为1mol,含有的电子数为10NA,故C正确;
D.62144Sm质子数、电子数为62,中子数为82;62150Sm质子数、电子数为62,中子数为88,故D错误;
故选:C.
点评 本题考查了同位素判断、电解质电离方程式的书写、质子数、中子数、电子数之间的关系,明确同位素概念、电解质电离方式是解题关键,题目难度不大.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.2NA | |
| B. | 常温常压下,1mol氦气所含原子数为2NA | |
| C. | 标准状况下,22.4L CCl4含有的氯原子数为4NA | |
| D. | 0.5mol•L-1 Na2CO3溶液中含有Na+离子的数目为NA |
15.下列各组离子反应可用H++OH-=H2O表示的是( )
| A. | 硝酸和氢氧化钠 | B. | 氢氧化铁和盐酸 | C. | 氢氧化钡和硫酸 | D. | 碳酸氢钠和盐酸 |
5.某有机物链状分子中含n个-CH2-,m个 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )| A. | m+n+a | B. | m+2-a | C. | 2n+3m-a | D. | m+2n+2-a |
9.下列微粒中半径最小的是( )
| A. | Ca2+ | B. | K | C. | S2- | D. | K+ |
17.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( ) 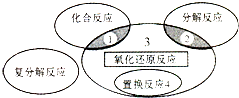

| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | D. | Zn+H2SO4═ZnSO4+H2↑ |