题目内容
20.最近,个别国家在南海问题上发表错误言论,但是中国人民有能力捍卫国家领海主权.南海资源丰富,海水开发利用的部分过程如图甲所示.(1)在海水获得淡水的诸多方法中,历史最久,技术和工艺也比较成熟,但成本较高的方法是蒸馏法.
(2)海洋植物如海带、海藻中含有丰富分碘元素,碘元素以离子的形式存在.实验室中模拟从海带提取碘的流程如图乙所示.
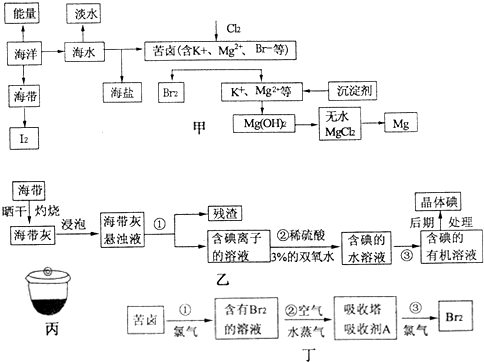
i.将海带放在如图丙所示的仪器中灼烧,该仪器的名称为坩埚.指出提取碘的过程中有关的实验操作名称①过滤.
ii.写出过程②中有关反应的离子方程式2I-+2H++H2O2=I2+2H2O.
iii.提取碘的过程③中可提供选择的有机试剂为b.
a.酒精、四氯化碳 b.四氯化碳、苯 c.汽油、醋酸
(3)从苦卤中提溴常用空气吹气法.其过程如图丁所示:
i.第①步和第③步发生的离子方程式相同,均生成Br2,那么该方法中还需第②③步,其目的是富集溴.
ii.吸收塔中吸收剂A是c.
a.NaOH b.Ca(OH)2 c.SO2
(4)工业生产中,由苦卤提溴后的溶液可得到金属Mg.
i.向苦卤提溴之后的溶液中加入沉淀剂,该沉淀剂可选用b.
a.NaOH b.Ca(OH)2 c.KOH
ii.由无水MgCl2冶炼金属Mg的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑.
分析 (1)利用蒸馏法控制水的沸点100°C,使水变为蒸气通过冷凝得到蒸馏水,能使海水淡化,但成本较高;
(2)i、溶固体在坩埚中灼烧,分离固体和液体用过滤;
ii、过程②中有关反应是碘离子为碘单质;
iii、萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(3)i、第①步和第③步发生的离子方程式相同,均生成Br2,目的是富集溴;
ii、吸收塔内是吸收空气吹出的溴蒸汽,吸收剂为二氧化硫,和溴单质反应生成硫酸和溴化氢;
(4)i、沉淀镁离子为氢氧化钙结合镁离子形成沉淀;
ii、无水氯化镁熔融电解生成镁和氯气.
解答 解:(1)在海水获去得淡水的诸多方法中,历史最久,技术和工艺也比较成熟,但成本较高的方法是蒸馏法,
故答案为:蒸馏法;
(2)i、将海带放在如3图所示的仪器中灼烧,该仪器为坩埚,过滤适用于不溶于水的固体和液体,提取碘的过程中有关的实验操作名称①为过滤,
故答案为:坩埚;过滤,
ii、过程②中有关反应是碘离子为碘单质,反应的离子方程式为:2I-+2H++H2O2=I2+2H2O,
故答案为:2I-+2H++H2O2=I2+2H2O;
iii、萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,
a.酒精、四氯化碳,酒精易溶于水,不能分层,故a错误;
b.四氯化碳、苯符合萃取剂的要求,可以萃取分液,故b正确;
c.汽油、醋酸中醋酸是溶于水的不能分层,不能做萃取剂,故c错误;
故答案为:b;
(3)i、第①步和第③步发生的离子方程式相同,均生成Br2,是利用过氧化氢氧化溴离子为溴单质,溴单质被二氧化硫氧化生成溴化氢,通入氯气氧化溴化氢为溴单质,操作的目的是富集溴,
故答案为:富集溴;
ii、吸收塔内是吸收空气吹出的溴蒸汽,吸收剂为二氧化硫,和溴单质反应生成硫酸和溴化氢,吸收剂A为二氧化硫,选择c,
故答案为:c;
(4)i、向苦卤提溴之后的溶液中加入沉淀剂,沉淀镁离子为氢氧化钙结合镁离子形成沉淀,氢氧化钙来源丰富且廉价,故选b,
故答案为:b;
ii、无水氯化镁熔融电解生成镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查学生卤素单质的性质,物质含量测定的实验设计和数据获得,溴单质的提取流程分析判断,出题方式新颖,有一定的思维空间,题目难度中等.

| A. | 人们直接用肉眼观察物质的颜色、状态 | |
| B. | 闻药品的气味 | |
| C. | 品尝物质的味道 | |
| D. | 借助仪器进行观察 |
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Mg(OH)2溶于硝酸:OH-+H+=H2O | |
| C. | Al与NaOH溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| A. | K2S | B. | NaOH | C. | SiO2 | D. | CO2 |
回答下列问题:
(1)海水淡化的方法主要是②(填序号).
①过滤 ②蒸馏 ③萃取 ④蒸发
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O=NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
| A. | 利用铝热反应大规模冶炼钢铁 | |
| B. | 用一氧化碳高温还原氧化铝提纯铝 | |
| C. | 西汉时期我国就采用“湿法冶铜”术 | |
| D. | 利用高温分解硫酸钙得到的二氧化硫制备硫酸 |
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 | |
| C. | 化合物YW2、ZW2都是酸性氧化物 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和4:2的化合物 |
