题目内容
下列离子方程式正确的是( )
| A、HCO3-水解的离子方程式:HCO3-+H2O═CO32-+H3O+ | ||
| B、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | ||
| C、过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | ||
D、新制氢氧化铜和乙醛反应:CH3CHO+2Cu(OH)2+OH-
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.HCO3-水解生成碳酸和OH-;
B.漂白粉溶液在空气中失效,反应生成碳酸钙和HClO;
C.过量的SO2通入NaOH溶液反应生成NaHSO3;
D.新制氢氧化铜和乙醛反应生成乙酸盐、氧化亚铜、水.
B.漂白粉溶液在空气中失效,反应生成碳酸钙和HClO;
C.过量的SO2通入NaOH溶液反应生成NaHSO3;
D.新制氢氧化铜和乙醛反应生成乙酸盐、氧化亚铜、水.
解答:
解:A.HCO3-水解的离子方程式为HCO3-+H2O═H2CO3+OH-,故A错误;
B.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,故B错误;
C.过量的SO2通入NaOH溶液中的离子反应为SO2-+OH-=HSO3-,故C错误;
D.新制氢氧化铜和乙醛反应的离子反应为CH3CHO+2Cu(OH)2+OH-
CH3COO-+Cu2O↓+3H2O,故D正确;
故选D.
B.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,故B错误;
C.过量的SO2通入NaOH溶液中的离子反应为SO2-+OH-=HSO3-,故C错误;
D.新制氢氧化铜和乙醛反应的离子反应为CH3CHO+2Cu(OH)2+OH-
| △ |
故选D.
点评:本题考查离子方程式的书写,为高频考点,把握发生的化学反应为解答本题的关键,侧重水解、氧化还原及与量有关的离子反应的考查,选项D为易错点,综合性较强,题目难度不大.

练习册系列答案
相关题目
25℃时,下列各物质的水溶液的pH小于7的是( )
| A、Na2CO3 |
| B、KOH |
| C、Fe2(SO4)3 |
| D、KHCO3 |
下列无色透明溶液中离子能大量共存的是( )
| A、Na+、Cu2+、NO3-、Cl- |
| B、Na+、Zn2+、OH-、Br- |
| C、K+、SO42-、Cl-、Mg2+ |
| D、Ba2+、Na+、OH-、CO32- |
在无色的强酸性溶液中能大量共存的是( )
| A、Mg2+、Na+、Cl-、SO42- |
| B、K+、Na+、Cl-、Cu2+ |
| C、K+、Na+、NO3-、CO32- |
| D、Na+、Ba2+、OH-、SO42- |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A、NaHB溶液不一定呈酸性,Na2B溶液不一定呈碱性 |
| B、在Na2B溶液中一定有:c(Na+)=2c(B2-)+c(HB-)+c(H2B) |
| C、NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-) |
| D、在Na2B溶液中一定有:2c(OH-)=c(H+)+c(HB-) |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 |
| B、与水反应时,水都做氧化剂 |
| C、与盐酸反应都只生成一种盐 |
| D、溶于水,所得溶液都能使无色酚酞变红 |
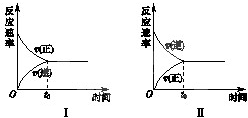 t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示:
t℃时,在两个相同的密闭刚性容器(恒容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)?2SO3(g),实验Ⅰ和实验Ⅱ的情况分别如图Ⅰ和图Ⅱ所示: Ⅰ.如图1为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:
Ⅰ.如图1为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答: 甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物: