题目内容
11.氨气是重要的化工原料.实验室可用浓氨水和ab来制取氨气.a.烧碱 b.生石灰 c.氯化铵
(2)某实验小组设计了下列装置进行氨的催化氧化实验.
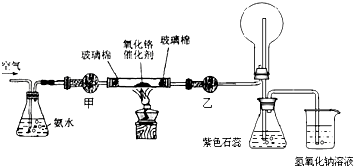
①盛放氨水的实验仪器的名称为锥形瓶;在加热条件下,硬质玻璃管中发生反应的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
②实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵.
③烧杯中盛有NaOH溶液的作用是吸收尾气,防止空气污染.
分析 (1)氨水易挥发,烧碱、生石灰溶于水放热,据此解答;
(2)①熟悉仪器形状,说出其名称;氨气催化氧化生成一氧化氮和水;
②一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵;
③尾气中含有氮的氧化物、氨气等气体,直接排放能够引起空气污染.
解答 解:(1)烧碱溶于水放出大量的热,生石灰与水反应氢氧化钙放热,可促使氨气挥发,可用于制备氨气,
故答案为:ab;
(2)①盛放氨水的实验仪器的名称为锥形瓶,氨气催化氧化生成一氧化氮和水,方程式:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
②一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵,所以如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,烧瓶中先产生白雾,随即产生白烟;
故答案为:一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵;
③尾气中含有氮的氧化物、氨气等气体,直接排放能够引起空气污染,通入氢氧化钠溶液,可以吸收尾气,防止空气污染;
故答案为:吸收尾气,防止空气污染.
点评 本题考查氨气的制备和性质的检验,熟悉制备原理和氨气的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.将下列各种液体:①苯;②四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是( )
| A. | ②⑤ | B. | 只有②④ | C. | ①②④⑤ | D. | ①②③④⑤ |
2.8月12日天津港发生爆炸,专家对爆炸事故原因猜测认为硝化棉或者硫化钠自燃是最可能的点火源,因此化学药品的安全存放是非常重要的.下列有关化学药品的存放说法不正确的是( )
| A. | 液溴易挥发,应用水液封并放在冷暗处保存 | |
| B. | 金属钠遇到氧气立即反应,应保存在煤油中或者液体石蜡里 | |
| C. | 硝酸见光易分解,应用棕色广口试剂瓶保存 | |
| D. | 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存 |
16. 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
3.可逆反应N2O4?2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是( )
①选用合适的催化剂; ②缩小体积; ③升高温度; ④增大N2O4的浓度.
①选用合适的催化剂; ②缩小体积; ③升高温度; ④增大N2O4的浓度.
| A. | ③④ | B. | ①②③ | C. | ②③④ | D. | ①④ |
20.下列实验现象描述错误的是( )
| A. | 硫在空气中燃烧,产生蓝紫色火焰 | |
| B. | 将二氧化碳通入水中,无明显现象 | |
| C. | 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 | |
| D. | 一氧化碳通过灼热的氧化铁,红色固体变黑 |