题目内容
下列有关化学用语,表达正确的是( )
A、Na2S的电子式: | B、铯-137:137Cs | C、O2-的结构示意图: | D、乙烯分子的球棍模型: |
分析:A.Na2S属于离子化合物,由钠离子与硫离子构成,简单阳离子电子式为其离子符号,阴离子应标出最外层电子式及成键情况,并用[]括起,在右上角注明所带电荷;
B.原子符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,元素符号已知,质子数可以省略,其中质量数=质子数+中子数;
C.氧原子获得2个电子形成氧离子,核电荷数不变;
D.球棍模型表示原子的相对大小、原子之间的成键情况及空间结构.
B.原子符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,元素符号已知,质子数可以省略,其中质量数=质子数+中子数;
C.氧原子获得2个电子形成氧离子,核电荷数不变;
D.球棍模型表示原子的相对大小、原子之间的成键情况及空间结构.
解答:解:A.Na2S属于离子化合物,由钠离子与硫离子构成,其电子式为 ,故A错误;
,故A错误;
B.铯-137指质量数为137的铯的一种同位素,原子符号为137Cs,故B错误;
C.氧原子获得2个电子形成氧离子,核电荷数不变,O2-的结构示意图为 ,选项中为Ne原子结构示意图,故C错误;
,选项中为Ne原子结构示意图,故C错误;
D.选项中模型表明了乙烯分子中原子的相对大小、原子之间的成键情况及乙烯分子空间结构,是乙烯分子的球棍模型,故D正确,
故选D.
 ,故A错误;
,故A错误;B.铯-137指质量数为137的铯的一种同位素,原子符号为137Cs,故B错误;
C.氧原子获得2个电子形成氧离子,核电荷数不变,O2-的结构示意图为
 ,选项中为Ne原子结构示意图,故C错误;
,选项中为Ne原子结构示意图,故C错误;D.选项中模型表明了乙烯分子中原子的相对大小、原子之间的成键情况及乙烯分子空间结构,是乙烯分子的球棍模型,故D正确,
故选D.
点评:本题考查常用化学用语,涉及电子式、原子符号、结构示意图、球棍模型,难度不大,注意对基础知识的理解掌握,注意电子式书写:简单阳离子电子式为其离子符号,复杂阳离子、阴离子应标出最外层电子式及成键情况,并用[]括起,在右上角注明所带电荷,掌握常见复杂离子电子式,若铵根离子、水合氢离子、氢氧根离子、过氧根离子等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
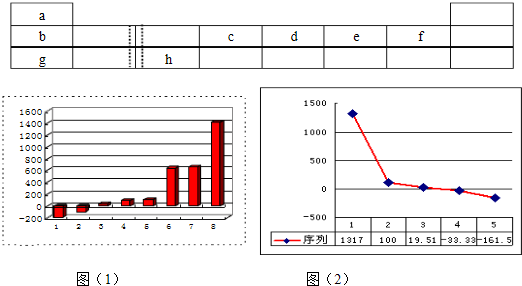
(8分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
| a | | | | | | | |
| b | | | c | d | e | f | |
| g | | h | | | | | |

(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是 晶体(填晶体的类型)。
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
,序列“2”的氢化物的结构式为 。
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是 (填选项序号)
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是_______________。
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是_____________(选填序号)

A.钠晶胞结构如图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径