��Ŀ����
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣

(1)ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ��Ӧ����ʽ��__________________��
�ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ���������Ӧ��________��Ӧ��
(2)��������ˮԡ���ò���ͬ��
��������________���ҵ�������________��
(3)��Ӧ����һ��ʱ������Թ�a�����ռ�����ͬ�����ʣ�������________������ƿ���ռ������������Ҫ�ɷ���________��
(4)���Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����________��Ҫ��ȥ�����ʣ������ڻ��Һ�м���________(��д��ĸ)��
a���Ȼ�����Һ b����
c��̼��������Һ d�����Ȼ�̼
Ȼ����ͨ��________(��ʵ���������)���ɳ�ȥ��
���𰸡�(1)2Cu��O2![]() 2CuO��CH3CH2OH��CuO
2CuO��CH3CH2OH��CuO![]() CH3CHO��Cu��H2O ����
CH3CHO��Cu��H2O ����
(2)���� ��ȴ (3)��ȩ���Ҵ���ˮ ����
(4)���� c ����
��������(1)��ʵ��ķ�Ӧԭ��Ϊ��2Cu��O2![]() 2CuO��CH3CH2OH��CuO
2CuO��CH3CH2OH��CuO![]() CH3CHO��H2O��Cu��
CH3CHO��H2O��Cu��
(2)(3)ʵ��װ���У����е�ˮΪ��ˮ���������ǽ���ˮ�Ҵ����ȳ��Ҵ������������һ����벣�����У���ͭ���������½��з�Ӧ�Ӳ������г�����������δ��Ӧ���Ҵ�����������O2��ˮ��������ȩ�����ʹ�����N2������һ��������У����е�ˮΪ��ˮ���������ǽ��Ҵ�������ˮ��������ȩ����������ȴ��ΪҺ�壬������ȴ������O2�ʹ�����N2���뵽����ƿ�С�
(4)������֪�������ʳ����ԣ�˵��������Ϊ���ᡣ��Ҫ��ȥ�Ҵ���ˮ����ȩ�е����ᣬ�����ڻ��Һ�м���NaHCO3��Һ������CH3COOH��NaHCO3��CH3COONa��H2O��CO2����Ӧ��ʹCH3COOHת��ΪCH3COONa����ͨ�����ɳ�ȥ��

����Ŀ�����붬��������ʼ��ů�����������������أ�����PM2.5��PM10������������������������������Ⱦ���У���Ϊ�������ǻ�����β���еĵ��������ȼú������������
��1����֪��ӦN2O4��g��2NO2��g����H�����¶����ߣ�����������ɫ�����һ����N2O4��������������һ��ʱ����о�ѹ����������������л���������������ʣ�������ɫԽdz������Խ����ʱ��仯�����
����˵����˵�����ʲ��ٷ����ı���� ��
a��������ɫ���ٸı� b����H���ٸı�
c��v����N2O4��=2v����NO2�� d��N2O4��ת���ʲ��ٸı�
��2����NH3����ԭNOx�������������������Ⱦ����ͼ������NH3����ԭ����������һ��������ͨ�����ֲ�ͬ�����������ݳ������е������ﺬ�����Ӷ�ȷ�������ѵ��ʣ�ע���ѵ��ʼ���������ת���ʣ�����Ӧԭ��Ϊ��NO��g��+NO2��g��+2NH3��g��2N2��g��+3H2O��g����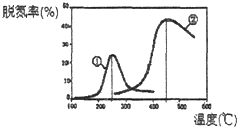
�ٸ÷�Ӧ�ġ�S0�����������=����������
������˵����ȷ���� ��
A���ڢ��ִ����ȵڢ��ִ����ѵ��ʸ�
B����ͬ�����£��ı�ѹǿ���ѵ���û��Ӱ��
C�������١��ڷֱ��ʺ���250���450�������ѵ�
��3����CH4����ԭNOxҲ�������������������Ⱦ��
��֪��CH4��g����ȼ����Ϊ890kJ/mol������1mol H2O��l����Ҫ����44kJ������
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H=��1114kJ/mol
2NO��g��+O2��g���T2NO2��g����H=��114kJ/mol
д��CH4����ԭNO2��g������N2��H2O��g�����Ȼ�ѧ����ʽ�� ��
��4�����¶�ΪT1���T2��ʱ���ֱ�0.5mol CH4��1.2mol NO2�������Ϊ1L���ܱ������У����NO2�����ʵ�����ʱ��仯�������±���
ʱ��/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | �� | 0.5 |
���¶�ΪT1��ʱ��0��20min�ڣ�v��CH4��= ��
��T1T2��������������¿�ͬ�����ж������� ��
��T1��ʱ����ӦCH4��g��+2NO2��g��N2��g��+CO2��g��+2H2O��g��ƽ�ⳣ��K=
���¶�ΪT2��ʱ����ƽ������������м���0.5mol CH4��1.2mol NO2 �� ����ƽ��ʱCH4��ת���ʽ� �����������С�����䡱����
����Ŀ����Ӧ��Fe��s��+CO2��g��FeO��s��+CO��g����H1=akJmol��1 �� ƽ�ⳣ��ΪK����Ӧ��CO��g��+ ![]() O2��g��CO2��g����H2=bkJmol��1 �� ����ڲ�ͬ�¶��£�Kֵ�����
O2��g��CO2��g����H2=bkJmol��1 �� ����ڲ�ͬ�¶��£�Kֵ�����
�¶�/�� | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
��1����500��ʱ���з�Ӧ�٣�CO2��ʼŨ��Ϊ2mol/L��CO��ƽ��Ũ��Ϊ ��
��2����Ӧ���е�a0������ڡ�����С�ڡ����ڡ�����
��3��700��ʱ��Ӧ�ٴﵽƽ�⣬Ҫʹ�ø�ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ�У�����ţ���
A.��С��Ӧ�����
B.ͨ��CO2
C.�����¶ȵ� 900��
D.ʹ�ú��ʵĴ���
��4����ͼͼ����Ϸ�Ӧ�ٵ��ǣ�����ţ���ͼ�Ц��ǻ������CO�ĺ�����TΪ�¶ȣ���
��5����Ӧ��2Fe��s��+O2��g���T2FeO��s����H3= ��



