题目内容
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
(1)已知反应N2O4(g)2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有 .
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(2)用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g).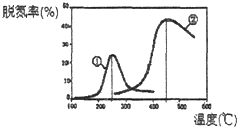
①该反应的△S0(填“>”、“=”或“<”).
②以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.
已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式: .
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)= .
②T1T2(填“>”或“<”,下空同);判断理由是 .
③T1℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K=
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将 (填“增大”、“减小”或“不变”).
【答案】
(1)ad
(2)>;C
(3)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844KJ/mol
(4)0.0125mol/(L.s);<;升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应;6.4;减小
【解析】解:(1.)透光率不再发生改变,说明二氧化氮的浓度不变,反应到达平衡,
a.气体颜色不再改变,说明二氧化氮浓度不变,透光率不再发生改变,故a正确;
b.焓变△H与是否到达平衡无关,与物质的聚集状态与化学计量数有关,故b错误;
c.应是2v正(N2O4)=v逆(NO2)时,反应到达平衡,二氧化氮的浓度不变,故c错误;
d.N2O4的转化率不再改变,反应到达平衡,二氧化氮的浓度不变,透光率不再发生改变,故d正确,
故选:ad;
(2.)①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S>0,故答案为:>;
②A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;
B.该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误;
C.由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故C正确;故选C;
(3.)已知:CH4(g)的燃烧热为890kJ/mol,热化学方程式若为:①CH4(g)+2O2(g)=CO2(g)+2H2O(l),△H=﹣890KJ/mol,
蒸发1mol H2O(l)需要吸收44kJ热量,热化学方程式,②H2O(l)=H2O(g),△H=44KJ/mol
③CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
④2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
依据盖斯定律计算,(①+②×2+③﹣④×2)× ![]() 得到CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844KJ/mol,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844KJ/mol;
得到CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844KJ/mol,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844KJ/mol;
(4.)①温度为T1℃时,0~20min内v(NO2)= ![]() =0.025mol/(L.s),速率之比等于化学计量数之比,则v(CH4)=
=0.025mol/(L.s),速率之比等于化学计量数之比,则v(CH4)= ![]() v(NO2)=0.0125mol/(L.s),故答案为:0.0125mol/(L.s);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,故温度T1<T2 , 温度T2先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动,故正反应为放热反应,则△H<0,故答案为:<;升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应;③温度为T1℃时,40min到达平衡,平衡时二氧化氮物质的量为0.4mol,则:
v(NO2)=0.0125mol/(L.s),故答案为:0.0125mol/(L.s);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,故温度T1<T2 , 温度T2先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动,故正反应为放热反应,则△H<0,故答案为:<;升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应;③温度为T1℃时,40min到达平衡,平衡时二氧化氮物质的量为0.4mol,则:
CH4(g) | + | 2NO2(g) | N2(g) | + | CO2(g) | + | 2H2O(g) | ||
起始量(mol): | 0.5 | 1.2 | 0 | 0 | 0 | ||||
变化量(mol): | 0.4 | 0.8 | 0.4 | 0.4 | 0.8 | ||||
平衡量(mol): | 0.1 | 0.4 | 0.4 | 0.4 | 0.8 |
容器的体积为1L,则平衡常数K= ![]() =
= ![]() =6.4,故答案为:6.4;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效再原平衡基础上增大压强,平衡逆向移动,达新平衡时CH4的转化率将减小,故答案为:减小;
=6.4,故答案为:6.4;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效再原平衡基础上增大压强,平衡逆向移动,达新平衡时CH4的转化率将减小,故答案为:减小;
(1.)透光率不再发生改变,说明二氧化氮的浓度不变,反应到达平衡;
(2.)①熵是用描述混乱程度的,△S就是混乱程度的变化,根据反应前后气体体积不会判断熵变;②A、催化剂只影响反应速率,不会改变转化率;B、根据反应原理可知,正反应是体积增大的反应,压强影响脱氮率;C、根据图象数据可知,催化剂①、②发挥增大催化效果的温度分别为250℃和450℃;
(3.)写出热化学方程式,结合盖斯定律计算得到所需热化学方程式;
(4.)①根据v= ![]() 计算v(NO2),再利用速率之比等于化学计量数之比计算v(CH4);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动;③化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出,温度为T1℃时,40min到达平衡,计算平衡时各组分浓度,代入平衡常数表达式计算;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效再原平衡基础上增大压强,平衡逆向移动;
计算v(NO2),再利用速率之比等于化学计量数之比计算v(CH4);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动;③化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出,温度为T1℃时,40min到达平衡,计算平衡时各组分浓度,代入平衡常数表达式计算;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效再原平衡基础上增大压强,平衡逆向移动;







