题目内容
(5分)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD,当反应进行一定时间
cC(s)+dD,当反应进行一定时间 后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
(1)该化学方程式各物质的化学计量数为a=_____、b=______、c=_____、d=______。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为______。
(3)若只升高温度, 反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
 cC(s)+dD,当反应进行一定时间
cC(s)+dD,当反应进行一定时间 后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:(1)该化学方程式各物质的化学计量数为a=_____、b=______、c=_____、d=______。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质D的聚集状态为______。
(3)若只升高温度,
 反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。(5分)(第3问是1分,其它各2分)
(1)2 1 3 2 (2)气态 (3)放热
1 3 2 (2)气态 (3)放热
(1)2
 1 3 2 (2)气态 (3)放热
1 3 2 (2)气态 (3)放热略

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
 ,2min后反应达到平衡, A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是
,2min后反应达到平衡, A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是
 小于0.4mol
小于0.4mol FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  推断:反应①是 (填“吸热”或“放热”)反应。
推断:反应①是 (填“吸热”或“放热”)反应。 是 (填“吸热”或“放热”)反应。
是 (填“吸热”或“放热”)反应。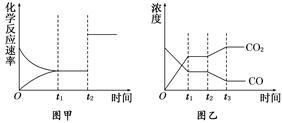
 2C(g)△H > 0 。下列反应条件都有利于生成C的是
2C(g)△H > 0 。下列反应条件都有利于生成C的是 CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
 NO(g)+CO2(g)并达到化学平衡,发现有50%的CO 转化为CO2。在其他条件不变的情况下,若将1molCO 和2 molNO2 充入上述容器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
NO(g)+CO2(g)并达到化学平衡,发现有50%的CO 转化为CO2。在其他条件不变的情况下,若将1molCO 和2 molNO2 充入上述容器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是 2NH3
2NH3  ,有关该反应的叙述正确的是( )
,有关该反应的叙述正确的是( ) 和3mol
和3mol 充分反应达到平衡时,放出的热量等于92.4kJ
充分反应达到平衡时,放出的热量等于92.4kJ )
) 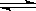 3C(g),已知加入1 molA和3 molB,平衡时A的物质的量为a mol。
3C(g),已知加入1 molA和3 molB,平衡时A的物质的量为a mol。 a的关系式表示)
a的关系式表示) 同一个容器中改为加入2 molA和6 molB,达到平衡后, C在混合气体中的体积百分含量 (填“增大”“减小”或“不变”)。
同一个容器中改为加入2 molA和6 molB,达到平衡后, C在混合气体中的体积百分含量 (填“增大”“减小”或“不变”)。