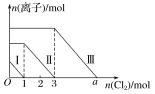
题目内容
【题目】碱式碳酸铜是一种用途广泛的化工原料,其化学式一般可表示为Cu(OH)2xCuCO3。某实验小组设计如下几个实验方案,测定碱式碳酸铜的组成,完成下列填空。
[方案一]用如图实验装置进行实验(夹持仪器省略),先通一段时间氮气,然后加热,加热完毕,再通一段时间氮气。
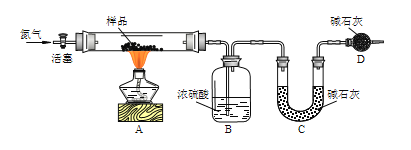
加热完毕再通一段时间氮气的作用是___。
若实验取14.200g样品,B装置增重0.900g,C装置增重3.300g,则x=___。
[方案二]用如图装置测定碱式碳酸铜与足量稀硫酸反应生成CO2的体积。
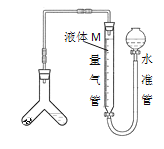
为了减小实验误差,量气管中液体M的选择原则是___。
通过实验,测得该试样中x值偏低,产生这种现象的原因可能是___
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
[方案三]该小组同学又用如下方案测定碱式碳酸铜的组成。
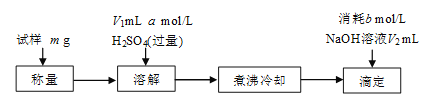
煮沸的目的主要是___。
若滴定时NaOH加入过量,则x值___(填“偏大”、“偏小”或“不变”)
【答案】将反应生成的水蒸汽和二氧化碳全部赶至装置B、C,被完全吸收 1.5 二氧化碳在M溶液中溶解度要小 d 将生成的二氧化碳全部赶出,避免影响滴定结果 偏大
【解析】
方案一:加热样品分解为CuO、二氧化碳与水,根据B中浓硫酸溶液增重测定生成水的质量,根据C中碱石灰增重测定生成二氧化碳的质量,D中碱石灰吸收空气中二氧化碳与水蒸气,防止其进入C中,根据硬质玻璃管中最终剩余固体为CuO,计算各自物质的量,根据原子守恒可以计算氢氧化铜、碳酸铜的物质的量,进而确定化学式;
方案二:利用排液体M测定二氧化碳的体积,则二氧化碳在溶体M中溶解性要小;
如果测得的二氧化碳的体积偏小,测得该试样中x值偏低,,据此分析;
方案三:硫酸与碱式碳酸铜反应生成硫酸铜与二氧化碳,煮沸赶出溶液中溶解的二氧化碳,再用氢氧化钠溶液滴定剩余的硫酸,可以计算参加反应硫酸物质的量,铜离子物质的量与消耗硫酸的物质的量相等,求出铜的含量,再结合碳酸铜和氢氧化铜中铜的含量分析。
方案一:要想准确的测定碱式碳酸铜的组成,必须保证产生的二氧化碳和水完全被吸收,所以加热完毕再通一段时间氮气是为了将反应生成的水蒸气和二氧化碳全部赶至装置B、C中被完全吸收;
B装置增重![]() ,则生成水为
,则生成水为![]()
C装置增重![]() ,则生成二氧化碳为:
,则生成二氧化碳为:![]() ,
,
由原子守恒可知,碱式碳酸铜中氢氧化铜为![]() ,碳酸铜为
,碳酸铜为![]() ,则1:
,则1:![]() :
:![]() ,解得
,解得![]() ;
;
方案二:为了减小实验误差,量气管中液体M的选择原则是:二氧化碳在M溶液中溶解度要小;
![]() 气体中含有水蒸气,测定二氧化碳的体积偏大,测得该式样中x值偏高,故a不符合;
气体中含有水蒸气,测定二氧化碳的体积偏大,测得该式样中x值偏高,故a不符合;
![]() 测定气体体积时未冷却至室温,冷却后二氧化碳体积较小,则测定二氧化碳体积偏大,测得该式样中x值偏高,故b不符合;
测定气体体积时未冷却至室温,冷却后二氧化碳体积较小,则测定二氧化碳体积偏大,测得该式样中x值偏高,故b不符合;
![]() 型管中留有反应生成的气体,同时排出等体积的空气,不影响二氧化碳体积的测量,故c不符合;
型管中留有反应生成的气体,同时排出等体积的空气,不影响二氧化碳体积的测量,故c不符合;
![]() 测定气体体积时水准管的液面高于量气管的液面,二氧化碳的压强比空气大被压缩,测定二氧化碳的体积偏小,则测得该式样中x值偏低,故d符合,
测定气体体积时水准管的液面高于量气管的液面,二氧化碳的压强比空气大被压缩,测定二氧化碳的体积偏小,则测得该式样中x值偏低,故d符合,
方案三:用氢氧化钠滴定剩余硫酸时,溶解在溶液中的二氧化碳能与氢氧化钠溶液反应,使测定剩余的硫酸偏大,故要加热煮沸将生成的二氧化碳全部赶出,避免影响滴定结果;
如果在滴定中加入氢氧化钠过量,会生成氢氧化铜沉淀,导致测定剩余硫酸物质的量偏大,消耗硫酸偏小,则沉淀中Cu质量偏小,而碳酸铜中Cu的质量分数小于氢氧化铜中Cu的质量分数,则沉淀碳酸铜的含量偏大,x值偏大。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案