题目内容
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 电池工作一段时间后,乙池溶液的总质量增加
B. 铜电极上发生氧化反应
C. 电池工作一段时间后,甲池的c(SO42-)减小
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】A
【解析】A. Zn2+由甲池移向乙池,Cu2+被还原为Cu,电池工作一段时间后,乙池溶液的总质量增加,故A正确;B. 铜电极为正极,发生还原反应,故B错误;C. 电池工作一段时间后,甲池的c(SO42-)不变,故C错误;D. 阳离子Zn2+通过阳离子交换膜向正极移动,同时Cu2+被还原为Cu,保持溶液中电荷平衡,故D错误。故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

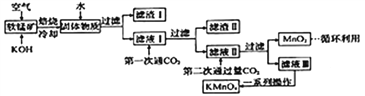
(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。