题目内容
【题目】用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备硫酸亚铁铵晶体[(NH4)xFe(SO4)y·6H2O]。硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
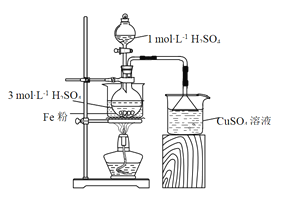
(1)实验装置:反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为_______。
(2)药品用量:将2 g Fe粉、10 mL 3 mol·L-1 H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是_______。
(3)制备FeSO4溶液:保持温度70~80 ℃,至反应无明显气泡产生,停止加热,过滤。
(4)制备(NH4)xFe(SO4)y·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80 ℃条件下溶解后,趁热倒入50 mL乙醇中,析出晶体。乙醇的作用为_______。
(5)测定化学式:将一定量(NH4)xFe(SO4)y·6H2O晶体加入到过量NaOH溶液中,并加热,生NH3 1.12 L(标准状况),过滤、洗涤、灼烧,得Fe2O3固体2.0 g。通过计算确定硫酸亚铁铵晶体的化学式。(写出计算过程)_______
【答案】4CuSO4+ PH3 + 4H2O = H3PO4 + 4H2SO4+ 4Cu↓ 避免Fe2+被氧化为Fe3+ 降低硫酸亚铁铵在水中溶解的量 (NH4)2Fe(SO4)2·6H2O
【解析】
利用硫酸铜和磷化氢反应生成铜和磷酸、硫酸,
铁与硫酸量的关系理解为何要按照此原料比加入,
根据硫酸亚铁铵不易被氧化,易溶于水,不溶于乙醇的知识推出加入乙醇的作用,
根据生成的量的关系分析铵根离子和亚铁离子的比,再根据电荷关系推出硫酸亚铁铵的化学式。
⑴用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为4CuSO4+ PH3 + 4H2O = H3PO4 + 4H2SO4+ 4Cu↓,
故答案为:4CuSO4+ PH3 + 4H2O = H3PO4 + 4H2SO4+ 4Cu↓;
⑵药品用量:将2 g Fe粉即物质的量约为0.036 mol,10 mL 3 mol·L-1 H2SO4溶液即物质的量为0.03mol,两者加入烧瓶中反应,铁粉略过量,主要是避免Fe2+被氧化为Fe3+,
故答案为:避免Fe2+被氧化为Fe3+;
⑷根据硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇,得出乙醇的作用为降低硫酸亚铁铵在水中溶解的量,
故答案为:降低硫酸亚铁铵在水中溶解的量;
⑸将一定量(NH4)xFe(SO4)y·6H2O晶体加入到过量NaOH溶液中,并加热,生成NH3 1.12 L即物质的量为0.05 mol,Fe2O3固体2.0 g绩物质的量为0.0125 mol,
n(NH3) = 0.05 mol,n(NH4+) = 0.05 mol,
n(Fe2O3) = 0.0125 mol,n(Fe) = 0.025 mol ,
n(Fe):n(NH4+) = 0.025 mol:0.05 mol = 1:2,
再根据电荷守恒得出(NH4) 2Fe(SO4)2·6H2O,
故答案为:(NH4) 2Fe(SO4)2·6H2O。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案