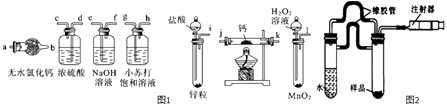
��Ŀ����
����Ŀ����ȸʯ����Ҫ�ɷ�ΪCu2��OH��2CO3 �� �����������������������������P����������ͼ1��ʵ�����Կ�ȸʯΪԭ���Ʊ��������������ͼ�� 
��ش��������⣺
��1����ҺA�еĽ��������� �� �����������Լ���ѡ��ʵ�鲽�����Լ���Ϊ������ţ�
a��KMnO4 b��HNO3c��H2O2 d��Cl2
��2������ͼ2�й����ݣ�����Ϊ��ҵ�ϼ����Լ�����������ʱӦ��ȡ�Ĵ�ʩ�ǣ���Һ�¶ȿ������棬pH������ �� ����ʱ��ΪСʱ���ң�
��3�����ⶨ��ҺA��Fe2+��Ũ�ȣ�����KMnO4����Һ�ζ�����Ӧ��MnO4����ԭΪMn2+ �� ȡA��Һ20.00mL����ȥ0.0240mol/L KMnO4��Һ16.00mLʱ��ǡ�ôﵽ�ζ��յ㣬��A��Һ��Fe2+Ũ��Ϊmol/L��
��4�������һ��ʵ�鷽��������ҺC��Fe3+�Ƿ���ȫ��ȥ��д���������衢����ͽ��ۣ� ��
��5������ҺC��õ������壬��Ҫ��������Ũ���������˵Ȳ��������ձ�©������˲������õ���һ�����������������ڴ˲����е���Ҫ������ ��
��6��Ϊ�ⶨ�����нᾧˮ��Ŀ����ȡ24.8g����ͭ����ʢװ�ڸ����
�����������ƣ���������������ٸı�ʱ��������ĩ������Ϊ16.0g���������õ�����CuSO4nH2O����n=����������ȷ��0.1����
���𰸡�
��1��Cu2+��Fe2+��Fe3+��c
��2��80��1.5��4
��3��0.096
��4��ȡ������Һ����������KSCN��Һ������Һ�����ɫ��˵��Fe3+����ȫ��ȥ������Һ���ɫ����˵��Fe3+δ��ȫ��ȥ
��5����ȴ�ᾧ������
��6��������4.9
���������⣺��1��������֪��ҺA��ҺA�еĽ��������У�Cu2+��Fe2+��Fe3+ �� ���Լ�1����Ŀ���ǽ���Һ�е�Fe2+ת��ΪFe3+ �� �Ҳ����������ʣ�����˫��ˮ��˫��ˮ��һ����ɫ�Լ�����Fe2+����ΪFe3+ �� �����������ʣ���ѡc��
���Դ��ǣ�Cu2+��Fe2+��Fe3+��c����2��������ͼ2�й����ݿ�֪��pHֵ���ʱ�¶�Խ��Fe2+ת����Խ�ߣ��¶����ʱpHֵԽСFe2+ת����Խ�ߣ����Թ�ҵ����������ʱӦ��ȡ�Ĵ�ʩ����Һ�¶ȿ�����80�棬pH������1.5������ʱ��Ϊ4Сʱ����Fe2+ת���ʴﵽ�ϴ�ֵ��4Сʱ�Ժ�仯����
���Դ��ǣ�80��1.5��4����3��Fe2+��Һ��KMnO4��Һ����������ԭ��Ӧ����Ӧ��MnO4������ԭΪMn2+ �� ��Ӧ�����ӷ���ʽΪMnO4��+5Fe2++8H+=Mn2++5Fe3++4H2O���������ӷ��̿�֪MnO4����5Fe2+ �� ��ȥ KMnO4�����ʵ���Ϊ16.00mL��0.0240mol/L=3.84��10��4mol������A��Һ��Fe2+Ũ��Ϊ ![]() =0.096mol/L��
=0.096mol/L��
���Դ��ǣ�0.096����4�������ӵļ��鷽��Ϊȡ������Һ����������KSCN��Һ������Һ�����ɫ��˵��Fe3+����ȫ��ȥ������Һ���ɫ����˵��Fe3+δ��ȫ��ȥ��
���Դ��ǣ�ȡ������Һ����������KSCN��Һ������Һ�����ɫ��˵��Fe3+����ȫ��ȥ������Һ���ɫ����˵��Fe3+δ��ȫ��ȥ����5������ҺC��õ������壬��Ҫ��������Ũ������ȴ�ᾧ������ϴ�ӵõ���ˮ����ͭ�����ձ�©������˲������õ���һ��������Ϊ���������������ڴ˲����е���Ҫ������������
���Դ��ǣ���ȴ�ᾧ����������6����ȡ24.8g����ͭ����CuSO4nH2O��ʢװ�ڸ�����������������������ٸı�ʱ��������ĩ������Ϊ16.0g����ͭ�����ʵ���= ![]() =0.1mol��
=0.1mol��
CuSO4nH2O���ʵ���Ϊ0.1mol��M=248g/mol��
��������Ϊˮ��������ˮ���ʵ���= ![]() =0.49mol��
=0.49mol��
��n=4.9
���Դ��ǣ�������4.9��

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�����Ŀ�����ڵؿ��еĺ����ϸߣ��輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣺
��1��1810����仯ѧ�ұ�������˹�ڼ���ʯӢɰ��ľ̿����ʱ���õ�һ�֡������������֡������������� ��
��2���մɡ�ˮ��Ͳ����dz��õĹ����β��ϣ����У�������ͨ��������Ҫԭ���� ��
��3���ߴ������ִ���Ϣ���뵼��������Ȳ�ҵ����Ҫ�Ļ������ϣ���ҵ���ᴿ���ж���·�ߣ�����һ�ֹ�������ʾ��ͼ����Ҫ��Ӧ���£� 
��������Ҫ��Ӧ | |
�绡¯ | SiO2+2C |
���������� | Si+3HCl |
��ԭ¯ | SiHCl3+H2 |
����ʯӢɰ�ͽ�̿�ڵ绡¯�и��¼���Ҳ��������̼���裬�÷�Ӧ�Ļ�ѧ����ʽΪ��̼�����ֳ� �� �侧��ṹ�����ƣ�
������������Ӧ�IJ����У�SiHCl3��Լռ85%������SiCl4��SiH2Cl2��SiH3Cl�ȣ��й����ʵķе��������±����ᴿSiHCl3����Ҫ���ղ��������dz����������� ��
���� | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
�е�/�� | 2355 | 57.6 | 31.8 | 8.2 | ��30.4 | ��84.9 | ��111.9 |
��SiHCl3����ˮ�⣬����ȫˮ��IJ���Ϊ ��
��4���ȼҵ��Ϊ�������������ṩ����ԭ�ϣ���Щԭ���� ��