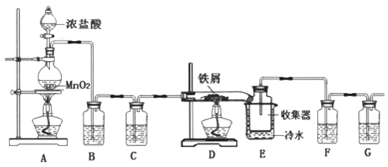
题目内容
8.下列叙述正确的是( )| A. | NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存 | |
| B. | H2O2的电子式是: | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁锈是化合物,可用Fe2O3•nH2O(2<n<3)表示 |
分析 A.铝离子与碳酸氢根离子发生双水解反应;
B.双氧水为共价化合物,分子中不存在阴阳离子;
C.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵;
D.Fe2O3•nH2O中n不能确定,则铁锈为混合物.
解答 解:A.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故A错误;
B.H2O2属于共价化合物,电子式中不能标出电荷,正确的电子式为 ,故B错误;
,故B错误;
C.AlCl3溶液中加入过量的氨水,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.化学式Fe2O3•nH2O中n不是定值,则铁锈为混合物,故D错误;
故选C.
点评 本题考查较为综合,涉及离子共存的判断、离子方程式书写及电子式等知识,题目难度中等,注意掌握离子方程式的书写原则,D为易错点,注意铁锈为混合物,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
18.判断下列有关化学基本概念或名词的依据正确的是( )
| A. | 共价化合物:是否含有共价键 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 电解质与非电解质:物质本身是否具有导电性 | |
| D. | 溶液与胶体:本质在于分散质粒子直径的大小 |
19.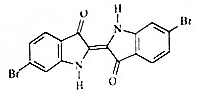 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )| A. | 属于烃的衍生物 | |
| B. | 分子式为C16H8O2N2Br2 | |
| C. | 1mol该有机物与H2加成最多消耗9molH2 | |
| D. | 该有机物溴元素检验可将有机物与碱液共热后,直接加入硝酸银溶液,观察是否有浅黄色沉淀生成. |
13.在自然界中不存在游离态的元素是( )
| A. | 碳 | B. | 硫 | C. | 铁 | D. | 铝 |
20.下列物质用加热的方法可分离的是( )
| A. | 氯化铵和消石灰固体 | B. | 碳酸氢铵和过氧化钠固体 | ||
| C. | 碘化钾和碘晶体 | D. | 硝酸钾与食盐晶体 |
17.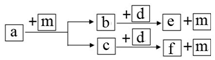 短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
 短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Z<Y | B. | 阴离子的还原性:Y>W | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | W2Y2 中含有非极性键 |
18.下列反应中,H2SO4只作氧化剂的是( )
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | 2SO2+O2+2H2O═2H2SO4 | ||
| C. | Cu+2H2SO4$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | D. | C+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2SO2↑+CO2↑+2H2O |