题目内容
7. 用石墨作电极,电解盛放在U形管中的饱和溶液和NaCl溶液(滴有酚酞溶液),如图,下列叙述正确的是( )
用石墨作电极,电解盛放在U形管中的饱和溶液和NaCl溶液(滴有酚酞溶液),如图,下列叙述正确的是( )| A. | 通电后,NaCl发生电离 | |
| B. | 通电一段时间后,阳极附近溶液先变红 | |
| C. | 当阳极生成0.1mol气体时,整个电路中转移了0.1mole- | |
| D. | 电解饱和食盐水的总反应式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
分析 用石墨作电极电解饱和氯化钠溶液,阴极发生还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,生成NaOH,该极呈碱性;阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,总反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,以此解答该题.
解答 解:A.NaCl为强电解质,无论是否通电,在溶液中都发生电离,故A错误;
B.阳极生成氯气,阴极生成NaOH,则阴极附近溶液先变红,故B错误;
C.阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,生成0.1mol氯气时,转移电子为0.2mole-,故C错误;
D.电解饱和食盐水,阳极生成氯气,阴极生成氢气和氢氧化钠,总方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故D正确.
故选D.
点评 本题考查电解原理,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,掌握离子放电顺序是解题的关键,注意基础知识的积累掌握.

练习册系列答案
相关题目
18.下列有关金属的工业制法中,正确的是( )
| A. | 制铁:以铁矿石为原料,CO还原得铁 | |
| B. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
2.下列解释事实的反应方程式不正确的是( )
| A. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 以Na2S为沉淀剂,除去溶液中的Cu2+:Cu2++S2-═CuS↓ | |
| D. | 向KI溶液中滴加稀硫酸和淀粉溶液,放置在空气中变蓝:4H++4I-+O2═2I2+2H2O |
12.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.

已知1:生成氢氧化物沉淀的pH
已知2:几种难容电解质的溶解度(20℃)
(已知:Fe+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.

已知1:生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 溶解度/g |
| Fe(OH)2 | 5.2×10-5 |
| Fe(OH)3 | 3×10-9 |
| MgCO3 | 3.9×10-2 |
| Mg(OH)2 | 9×10-4 |
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO).
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色.说明漂液就有的性质是碱性、强氧化性.
②用化学用语表示NaClO溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
③步骤Ⅱ中漂液的主要作用是将Fe2+氧化为Fe3+.
④若用H2O2代替漂液,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去.
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为Mg2++CO32-=MgCO3↓.
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因沉淀物MgCO3存在溶解平衡MgCO3(s)?Mg2+(aq)+CO32-(aq),CO32-发生水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,在煮沸情况下促进CO32-水解,Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3,分解为CO2和H2O,最后MgCO3转化为Mg(OH)2.
5.蛋白质发生的下列过程中,可逆的是( )
| A. | 变性 | B. | 加入酒精 | C. | 加入氯化铵 | D. | 加入浓硫酸 |
6.所有原子都满足最外层8电子稳定结构的化合物分子是( )
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | N2 |
 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-. .
.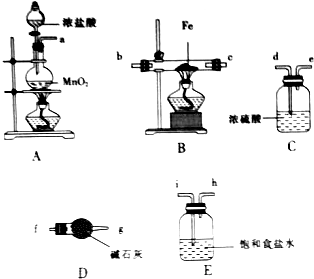 氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.某研究小组采用如图所示的装置制备少量纯净的氯化铁.
氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.某研究小组采用如图所示的装置制备少量纯净的氯化铁.