题目内容
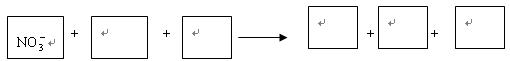
 (1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
(1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).NO3-+
10Al
10Al
+18H2O
18H2O
→10Al(OH)3
10Al(OH)3
+3N2
3N2
+6OH-
6OH-
该反应过程中,被氧化与被还原的元素的物质的量之比为5:3
5:3
.(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=-a KJ/mol
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式:
2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(
a-b-
c)KJ/mol
| 1 |
| 2 |
| 3 |
| 2 |
2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(
a-b-
c)KJ/mol
.| 1 |
| 2 |
| 3 |
| 2 |
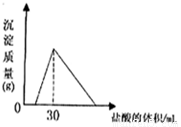
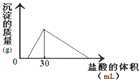
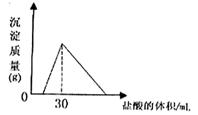
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为
2.016
2.016
L(标准状况).分析:(1)反应中NO3-→N2,N元素化合价由+5价降低为0价,共降低10价,Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH-是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据电荷守恒、元素守恒配平其它物质的系数.
根据方程式判断被氧化与被还原的元素的物质的量之比.
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式.
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH-)+n(AlO2-),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl),根据钠元素守恒有n(NaCl)=n(Na)=n(Na+),PH=14的溶液中c(OH-)=1mol/L,计算n(AlO2-),n(Al)=n(AlO2-),根据电子转移守恒计算n(H2),再根据V=nVm计算氢气体积.
根据方程式判断被氧化与被还原的元素的物质的量之比.
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式.
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH-)+n(AlO2-),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl),根据钠元素守恒有n(NaCl)=n(Na)=n(Na+),PH=14的溶液中c(OH-)=1mol/L,计算n(AlO2-),n(Al)=n(AlO2-),根据电子转移守恒计算n(H2),再根据V=nVm计算氢气体积.
解答:解:(1)反应中NO3-→N2,N元素化合价由+5价降低为0价,共降低10价,Al→Al(OH)3,Al元素化合价由0价升高为+3价,共升高3价,根据电荷守恒可知OH-是生成物,由H元素守恒可知H2O是反应物,化合价升降最小公倍数为30,故N2系数为3,Al系数为10,根据N元素守恒可知NO3-系数为6,根据Al元素守恒可知Al(OH)3系数为10,电荷守恒可知OH-系数为6,根据H元素守恒可知H2O系数为,配平后离子方程式为6NO3-+10Al+18H2O=10Al(OH)3+3N2+6OH-.由方程式可知被氧化与被还原的元素的物质的量之比10:6=5:3.
故答案为:10Al、18H2O=10Al(OH)3、3N2、6OH-;5:3.
(2)已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=-a KJ/mol
②Fe2O3(s)+
C(s)=
CO2(g)+2Fe (s)△H=+b KJ/mol
③C(s)+O2(g)=CO2(g)△H=-c KJ/mol
由盖斯定律可知,②-③×
+①×
得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(
a-b-
c)KJ/mol.
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(
a-b-
c)KJ/mol.
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH-)+n(AlO2-),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH-)=1mol/L,n(OH-)=0.02L×1mol/L=0.02mol,所以n(AlO2-)=0.06mol-0.02mol=0.04mol,所以
n(Al)=n(AlO2-)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.
故答案为:2.016.
故答案为:10Al、18H2O=10Al(OH)3、3N2、6OH-;5:3.
(2)已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=-a KJ/mol
②Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
③C(s)+O2(g)=CO2(g)△H=-c KJ/mol
由盖斯定律可知,②-③×
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-(
| 1 |
| 2 |
| 3 |
| 2 |
(3)由图可知加入盐酸不与立刻生成沉淀,说明盐酸先中和氢氧化钠,故合金全部溶解所得溶液为氢氧化钠与偏铝酸钠混合溶液,溶液中n(Na+)=n(OH-)+n(AlO2-),当加入盐酸30mL时,沉淀量最大,此时溶液为氯化钠溶液,根据氯元素守恒有n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol,根据钠元素守恒有n(NaCl)=n(Na)=n(Na+)=0.06mol,PH=14的溶液中c(OH-)=1mol/L,n(OH-)=0.02L×1mol/L=0.02mol,所以n(AlO2-)=0.06mol-0.02mol=0.04mol,所以
n(Al)=n(AlO2-)=0.04mol,根据电子转移守恒n(H2)×2=n(Na)×1+n(Al)×3,2n(H2)=0.06mol+0.04mol×3=0.18mol,故n(H2)=0.09mol,V(H2)=0.09mol×22.4L/mol=2.016L.
故答案为:2.016.
点评:考查氧化还原反应配平、热化学方程式书写、混合物反应的计算等,难度中等,(3)中根据图象分析清楚反应过程是关键,利用守恒计算比常规方法容易计算,注意计算中守恒思想的运用.

练习册系列答案
相关题目


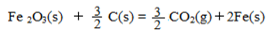 △H = +230 kJ/mol
△H = +230 kJ/mol 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO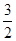 C(s)=
C(s)=