题目内容
(1)环境专家认为可以用金属铝将水体中的NO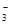 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO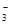 、N2,请将各粒子分别填入以下空格内。
、N2,请将各粒子分别填入以下空格内。
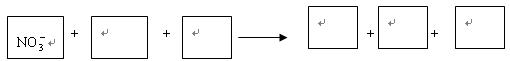
NO3—+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+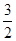 C(s)=
C(s)=
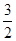 CO2(g)+2Fe(s)
△H=+234.1kJ/mol
CO2(g)+2Fe(s)
△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
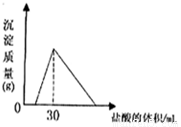
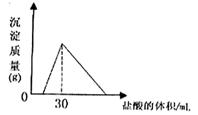
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如右图,则合金的质量为 克。
【答案】
(10分)(1)6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH― 5:3
(2)性质稳定,接触面积大
(3)2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ /mol
(4)2.46(每空2分)
【解析】

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
(1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).

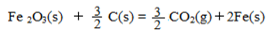 △H = +230 kJ/mol
△H = +230 kJ/mol