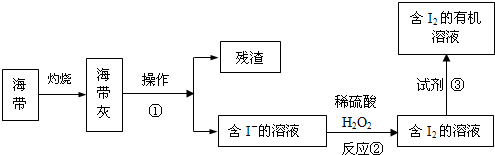
题目内容
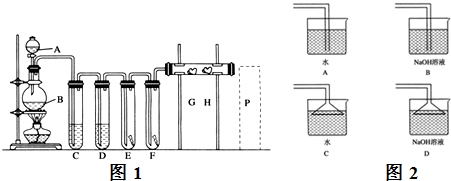
实验室用下述装置制取氯气,并用氯气进行下列实验.回答下列问题:
(1)A、B两仪器的名称:A
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成
(5)P处为尾气吸收装置,写出实验室利用烧碱溶液吸取Cl2的离子方程式:
(6)B中发生反应的化学方程式为
分析:(1)分析装置图中仪器作用和图形写出名称;
(2)从发生装置出来的氯气中含有杂质HCl和水蒸气,通过盛有饱和食盐水的洗气瓶除去HCl,通过盛有浓硫酸的洗气瓶除去氯气中的水蒸气;
饱和食盐水;吸收氯气中的水蒸气;
(3)氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色,所以E中无变化,F中红色布条褪色;
(4)氯气和碘化钾溶液中的碘离子反应生成碘单质.碘遇到淀粉变蓝;通过溴化钠溶液中的溴离子被氧化为溴单质;
(5)氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水;
(6)实验室用二氧化锰与浓盐酸反应制备氯气据此写出化学方程式;二氧化锰只能与浓盐酸反应,与稀盐酸不反应.
(2)从发生装置出来的氯气中含有杂质HCl和水蒸气,通过盛有饱和食盐水的洗气瓶除去HCl,通过盛有浓硫酸的洗气瓶除去氯气中的水蒸气;
饱和食盐水;吸收氯气中的水蒸气;
(3)氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色,所以E中无变化,F中红色布条褪色;
(4)氯气和碘化钾溶液中的碘离子反应生成碘单质.碘遇到淀粉变蓝;通过溴化钠溶液中的溴离子被氧化为溴单质;
(5)氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水;
(6)实验室用二氧化锰与浓盐酸反应制备氯气据此写出化学方程式;二氧化锰只能与浓盐酸反应,与稀盐酸不反应.
解答:解:(1):(1)装置图中仪器作用和图形可知是利用分液漏斗向烧瓶中加入浓盐酸加热反应生成氯气的发生装置,
故答案为:分液漏斗;圆底烧瓶;
(2)从发生装置出来的氯气中含有杂质HCl和水蒸气,通过盛有饱和食盐水的洗气瓶除去HCl,通过盛有浓硫酸的洗气瓶除去氯气中的水蒸气;
故答案为:饱和食盐水;吸收氯气中的水蒸气;
(3)氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色,所以E中无变化,F中红色布条褪色;
故答案为:F;
(4)氯气和碘化钾溶液中的碘离子反应生成碘单质.碘遇到淀粉变蓝;Cl2也能将Br-氧化为Br2,离子方程式为:2Br-+Cl2═2Cl-+Br2;
故答案为:蓝色;2Br-+Cl2═2Cl-+Br2;
(5)氯气通入到氢氧化钠溶液发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)二氧化锰与浓盐酸反应生成氯气、氯化锰和水,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;二氧化锰只能和浓盐酸反应反应,随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应.
故答案为:分液漏斗;圆底烧瓶;
(2)从发生装置出来的氯气中含有杂质HCl和水蒸气,通过盛有饱和食盐水的洗气瓶除去HCl,通过盛有浓硫酸的洗气瓶除去氯气中的水蒸气;
故答案为:饱和食盐水;吸收氯气中的水蒸气;
(3)氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色,所以E中无变化,F中红色布条褪色;
故答案为:F;
(4)氯气和碘化钾溶液中的碘离子反应生成碘单质.碘遇到淀粉变蓝;Cl2也能将Br-氧化为Br2,离子方程式为:2Br-+Cl2═2Cl-+Br2;
故答案为:蓝色;2Br-+Cl2═2Cl-+Br2;
(5)氯气通入到氢氧化钠溶液发生反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)二氧化锰与浓盐酸反应生成氯气、氯化锰和水,反应方程式为:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
点评:本题考查了实验室制备氯气的发生装置、除杂、性质检验、尾气处理的分析判断,除杂剂的选择注意结合氯气和杂质气体的性质,题目难度中等.

练习册系列答案
相关题目
实验室用浓盐酸、MnO2共热制取Cl2,并用Cl2和Ca(OH)2反应制取少量漂白粉,现已知反应2Cl2+2Ca(OH)2====Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应:6Cl2+6Ca(OH)2====Ca(ClO3)2+5CaCl2+6H2O。
现有三个同学分别设计三套实验装置如下:
(1)请从:a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境几个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项填在空格内。
装置 | 优点 | 缺点 |
甲 |
|
|
乙 |
|
|
丙 |
|
|
(2)图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从下述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号):_____________________。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________________(假定各步反应均无反应物损耗且无副反应发生)。
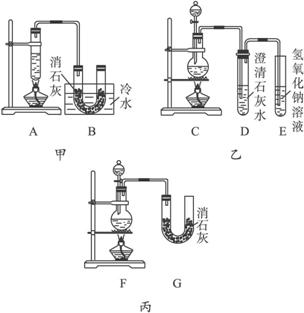
图6-31
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题