题目内容
17.化学与生活密切相关,下列说法不正确的是( )| A. | 糖类、油脂、蛋白质都能发生水解 | |
| B. | Na2CO3、NaHCO3可用作食用碱或工业用碱 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂或生产燃料油 | |
| D. | 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
分析 A.单糖不能水解;
B.碳酸钠、碳酸氢钠都属于强碱弱酸盐,其水溶液都具有碱性;
C.地沟油属于油脂,能燃烧,且在碱性条件下能水解;
D.乙醇易被氧化生成乙酸,乙酸和乙醇在一定条件下反应生成具有香味的乙酸乙酯.
解答 解:A.单糖不能水解,如葡萄糖和果糖不能水解,但二糖、多糖、蛋白质和油脂在一定条件下能水解,故A错误;
B.碳酸钠、碳酸氢钠都属于强碱弱酸盐,其酸根离子都易水解而使其水溶都具有碱性,可以用作食用碱或工业用碱,故B正确;
C.地沟油属于油脂,能燃烧而作为燃料,且在碱性条件下能水解高级脂肪酸盐而作肥皂,故C正确;
D.乙醇易被氧化生成乙酸,乙酸和乙醇在一定条件下反应生成具有香味的乙酸乙酯,所以“酒是陈的香”,故D正确;
故选A.
点评 本题考查化学与生活,为高频考点,明确物质成分及其性质是解本题关键,会运用化学知识解释生产生活现象,侧重考查学生知识运用能力,易错选项是A.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
8.下列电解质溶液中,微粒的物质的量浓度关系一定正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 25℃时,0.1 mol•L-1CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,浓度均为0.1 mol•L-1的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
5.下列离子方程式正确的是( )
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O | |
| B. | 苯酚与碳酸钠溶液: +CO32-→ +CO32-→ +H2CO3 +H2CO3 | |
| C. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
12.某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是均为第ⅤⅡA单质,氧化性均较强.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe3+氧化,离子方程式为2Fe2++Br2=2Fe3++2Br-.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象.
实验3:进行实验以确定可能的原因
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
你认为实验4设计的主要目的是亚铁离子与空气接触会被氧化,加入乙酸乙酯既可作为萃取剂又能起到液封的作用,减少空气对实验的影响.
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe3+的能力逐渐减弱,用原子结构解释原因:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱.
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是均为第ⅤⅡA单质,氧化性均较强.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe3+氧化,离子方程式为2Fe2++Br2=2Fe3++2Br-.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象.
实验3:进行实验以确定可能的原因
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe3+的能力逐渐减弱,用原子结构解释原因:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱.
2.甲同学进行Fe2+还原性的实验,针对异常现象进行探究.
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | 取2 mL BaCl2溶液,滴加2滴0.1 mol•L-1KSCN溶液和5滴5% H2O2溶液 | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol•L-1 FeCl3溶液 | 无明显现象 |
9.对下列物质中锰元素化合价的判断,正确的是( )
| A. | KMnO4中为+3 | B. | MnSO4中为-2 | C. | K2MnO4中为+6 | D. | MnO2中为+2 |
6.下列物质属于纯净物的是( )
| A. | 汽油 | B. | 红酒 | C. | 干冰 | D. | 碘酒 |
7.下列说法不正确的是( )
| A. | 天然油脂没有固定的熔、沸点 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
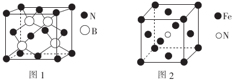
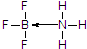 (标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.
(标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.