题目内容
15.巴豆酸的结构简式为CH3-CH=CH-COOH,试根据其结构特点,判断在一定条件能与巴豆酸发生取代反应的是( )| A. | 溴水 | B. | NaHCO3溶液 | C. | 乙醇 | D. | 酸性KMnO4溶液 |
分析 由结构可知,分子中含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:A.含碳碳双键,与溴水发生加成反应,故A不选;
B.含-COOH,与碳酸氢钠发生复分解反应,故B不选;
C.含-COOH,与乙醇发生酯化反应,属于取代反应,故C选;
D.含碳碳双键,能被酸性高锰酸钾氧化,为氧化反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃、羧酸的性质,题目难度不大.

练习册系列答案
相关题目
5.下列有关金属晶体的说法中,正确的是( )
| A. | 铁的晶胞中空间利用率为74% | |
| B. | 晶胞中配位数为12的金属,一定是面心立方最密堆积 | |
| C. | Zn的晶胞类型与铜相同 | |
| D. | 简单立方堆积的晶胞中原子配位数是8 |
6.下列实验操作中正确的是( )
| A. |  向试管中滴加液体 | B. |  检查装置的气密性 | ||
| C. |  移走加热的蒸发皿 | D. |  加热液体 |
3.下列属于强电解质的是( )
| A. | NaCl溶液 | B. | HClO | C. | NaOH | D. | 蔗糖 |
10.下列说法中锗误的有几个( )
①根据红外光谱图的分析可以初步判断有机物中含有哪些基团
②分子组成相差一个或几个CH2原子团的有机物是同系物
③同系物一定同类,且电子数之差-定为8的整数倍
④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似.
①根据红外光谱图的分析可以初步判断有机物中含有哪些基团
②分子组成相差一个或几个CH2原子团的有机物是同系物
③同系物一定同类,且电子数之差-定为8的整数倍
④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
20. 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
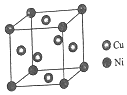
(4)某镍白铜合金的立方晶胞结构如图所示.
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
7.锂(Li)是世界上最轻的金属,它属于碱金属的一种,下列说法正确的是( )
| A. | 和Li同一主族的都是金属元素 | B. | Na+比Li多一个电子层 | ||
| C. | Li、Na、K+的最外层都只有一个电子 | D. | Li是碱金属中原子半径最小的原子 |
5.银锰精矿是重要的银矿资源,其主要成分为MnO2和银单质,利用黄铁矿(主要成分为FeS2)可以实现锰和银的分离.具体操作流程如图1

(1)提高锰元素浸出率的措施(任写一条)加热或粉碎或充分搅拌等.
(2)浸出1中,黄铁矿转化为铁盐和硫酸盐,请写出发生反应的化学方程式2FeS2+15MnO2+14H2SO4=Fe2(SO4)3+15MnSO4+14H2O.
(3)从工业生产成本考虑,加入的A最好是A.
A.CaCO3 B.NaOH C.氨水 D.Ca(OH)2
(4)浸出液2的主要成分Ag(CN)2-,写出浸出2中发生反应的离子方程式4Ag+O2+8CN-+2H2O=4 Ag(CN)2-+4OH-;电解后的溶液中,可以循环利用的物质NaCN(或CN-)(填化学式).
(5)如图2可知,当液固比(水与矿料的质量比)大于5时,浸出率反而降低的原因NaCN 浓度降低,浸取速率低.
(6)银锰矿中,银矿物以显微粒状分散在MnO2矿物中,不破坏原有结构难以提银,因此锰的浸出对于银的提取率至关重要.某小组通过实验,研究了硫酸用量、黄铁矿用量(占矿重百分比)对锰浸出率的影响,如表所示:
从实际生产角度出发,表中所给浸出条件最佳的是C.

(1)提高锰元素浸出率的措施(任写一条)加热或粉碎或充分搅拌等.
(2)浸出1中,黄铁矿转化为铁盐和硫酸盐,请写出发生反应的化学方程式2FeS2+15MnO2+14H2SO4=Fe2(SO4)3+15MnSO4+14H2O.
(3)从工业生产成本考虑,加入的A最好是A.
A.CaCO3 B.NaOH C.氨水 D.Ca(OH)2
(4)浸出液2的主要成分Ag(CN)2-,写出浸出2中发生反应的离子方程式4Ag+O2+8CN-+2H2O=4 Ag(CN)2-+4OH-;电解后的溶液中,可以循环利用的物质NaCN(或CN-)(填化学式).
(5)如图2可知,当液固比(水与矿料的质量比)大于5时,浸出率反而降低的原因NaCN 浓度降低,浸取速率低.
(6)银锰矿中,银矿物以显微粒状分散在MnO2矿物中,不破坏原有结构难以提银,因此锰的浸出对于银的提取率至关重要.某小组通过实验,研究了硫酸用量、黄铁矿用量(占矿重百分比)对锰浸出率的影响,如表所示:
| 硫酸% | 31.52 | 36.10 | 40.67 | 45.25 |
| 锰浸出率 | 77.42 | 89.49 | 91.59 | 97.95 |
| 黄铁矿% | 12.5 | 15 | 17.5 | 20 |
| 锰浸出率 | 88.79 | 97.95 | 99.18 | 99.46 |
| A | 硫酸45.25% | B | 硫酸31.52% | C | 硫酸45.25% | D | 硫酸36.10% |
| 黄铁矿20% | 黄铁矿15% | 黄铁矿15% | 黄铁矿20% |