题目内容
12.已知25℃时,几种弱酸的电离常数如下:| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用0.1mol/L的NaOH溶液滴定PH值相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大 | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-d mol/L |
分析 A.电离平衡常数越大,酸性越强,其对应盐的水解程度越小,盐溶液的pH越小;
B.酸性越强,等pH时,酸的浓度越小;
C.根据电荷守恒分析;
D.NaCN溶液中氢离子和氢氧根离子均为水电离,根据Kw计算.
解答 解:A.电离平衡常数越大,酸性越强,其对应盐的水解程度越小,盐溶液的pH越小,由表格中的数据可知,酸性:CH3COOH>H2S>HCN>HS-,所以等物质的量浓度溶液的pH关系为pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa),故A正确;
B.酸性越强,等pH时,酸的浓度越小,已知CH3COOH的酸性大于HCN,则等pH时,HCN的浓度大,所以HCN消耗的NaOH溶液体积更大,故B错误;
C.NaHS和Na2S的混合溶液中存在电荷守恒,所以一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故C错误;
D.某浓度的NaCN溶液的pH=d,则c(H+)=10-d mol/L,该溶液中c(OH-)=10d-14mol/L,所以水电离出的c(OH-)=10d-14mol/L,故D错误;
故选A.
点评 本题考查电离、水解及溶液中离子浓度的关系,综合性较强,题目难度中等,注意题干中数据的应用来解答,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
2.原子结构决定元素的性质,下列说法中正确的是( )
| A. | Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 | |
| B. | 在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O | |
| C. | 第二周期元素的最高正化合价都等于其原子的最外层电子数 | |
| D. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
17.如果不慎将苯酚沾在皮肤上,下列处理方法正确的是( )
| A. | 用溴水处理 | B. | 用氢氧化钠溶液洗涤 | ||
| C. | 用水洗 | D. | 用酒精洗涤 |
4.已知二氯丁烷的同分异构体共有9种,则八氯丁烷的同分异构体的种数为( )
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
1.如表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)NH3电子式是: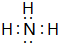 ;
;
(3)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>S.(用元素符号表示)
(4)①、⑥、⑦的最高价氧化物对应水化物的酸性最强的是HClO4>H2SO4>H2CO3.(用化学式表示)
(5)写出 ⑥的原子结构示意图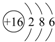 ;
;
(6)③氢化物的沸点大于(填“大于”、“小于”)⑥的氢化物的沸点.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)NH3电子式是:
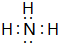 ;
;(3)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>S.(用元素符号表示)
(4)①、⑥、⑦的最高价氧化物对应水化物的酸性最强的是HClO4>H2SO4>H2CO3.(用化学式表示)
(5)写出 ⑥的原子结构示意图
 ;
;(6)③氢化物的沸点大于(填“大于”、“小于”)⑥的氢化物的沸点.
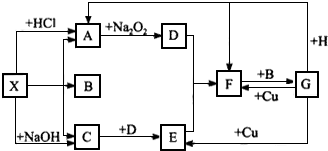
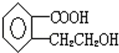 1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.
1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.