题目内容
10.有关反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,的下列说法错误的是( )| A. | FeS2既是氧化剂也是还原剂 | |
| B. | CuSO4在反应中被还原 | |
| C. | 14 mol CuSO4氧化了1 mol FeS2 | |
| D. | 被还原的S和被氧化的S的质量之比为3:7 |
分析 该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,Cu元素被还原、S元素被氧化和还原,据此分析解答.
解答 解:A.该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,所以FeS2既是氧化剂,又是还原剂,故A正确;
B.根据元素化合价知,部分FeS2和硫酸铜作氧化剂,故B正确;
C.由方程式可知14molCuSO4发生反应,有3molS被氧化,所以氧化了1.5 mol FeS2,故C错误;
D.根据C知,被氧化的S和被还原的S质量比为7:3,故D正确;
故选C.
点评 本题考查了氧化还原反应,根据元素化合价变化来分析解答即可,注意FeS2中S元素化合价,知道FeS2的作用,为易错点.

练习册系列答案
相关题目
20.在含Na2CO3和NaHCO3各1mol的混合溶液中加入0.5mol下列物质,其中能使HCO3-的数目均减少,CO32-数目增加的是( )
| A. | 浓盐酸 | B. | Na2SO4浓溶液 | C. | NaOH浓溶液 | D. | Ba(OH)2浓溶液 |
1.下列物质既可以做防腐剂,又可以做调味剂的是( )
| A. | 食盐 | B. | 亚硝酸钠 | C. | 柠檬黄 | D. | 味精 |
18.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1mol Fe溶于过量稀硝酸,电子转移数为2NA | |
| B. | 标准状况下,2.24L CCl4含有分子的数目为0.1NA | |
| C. | 46g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1L 0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA |
15. 某实验小组同学探究铜与硝酸的反应.
某实验小组同学探究铜与硝酸的反应.
(1)按不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液与铜片反应,如表:
①铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,若生成标准状况下0.56LNO气体,反应中被还原的HNO3的质量为1.58g
②依据表,制备NO气体最适宜的是实验Ⅱ,理由是产物是NO,反应速率较快(不用加热).
(2)为防止有毒气体逸出造成空气污染,该小组同学改进实验装置,如图所示(夹持仪器略去).用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性.
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触钢丝).
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始.
Ⅳ.当液面重新下降至与铜线脱离接触时,反应停止.
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象.
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水且产生一段高于A管的水柱,若观察到A、B间形成液面差,且保持不变,说明装置气密性良好.
②步骤Ⅲ操作的目的是赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色.
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是重复步骤Ⅴ的操作(或答“向下移动B管,使A中迅速进入空气,关闭旋塞C,待气体变为红棕色,反复上述操作”).
 某实验小组同学探究铜与硝酸的反应.
某实验小组同学探究铜与硝酸的反应.(1)按不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液与铜片反应,如表:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率快,溶液变成蓝色,大量气泡冒出,气体呈无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后加快,溶液变成蓝色,气泡冒出,气体无色 |
②依据表,制备NO气体最适宜的是实验Ⅱ,理由是产物是NO,反应速率较快(不用加热).
(2)为防止有毒气体逸出造成空气污染,该小组同学改进实验装置,如图所示(夹持仪器略去).用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性.
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触钢丝).
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始.
Ⅳ.当液面重新下降至与铜线脱离接触时,反应停止.
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象.
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水且产生一段高于A管的水柱,若观察到A、B间形成液面差,且保持不变,说明装置气密性良好.
②步骤Ⅲ操作的目的是赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色.
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是重复步骤Ⅴ的操作(或答“向下移动B管,使A中迅速进入空气,关闭旋塞C,待气体变为红棕色,反复上述操作”).
2. 在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
 在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )
在一定温度和压强下,使Mg和Zn分别与等浓度、等体积的过量稀盐酸反应,产生气体的体积(V)与反应时间(t)的关系如图所示.下列叙述正确的是( )| A. | 曲线a代表的是Zn的反应,曲线b代表的是Mg的反应 | |
| B. | 两个反应分别在2min、3min时达到化学平衡 | |
| C. | Mg和Zn的反应速率之比为3:2 | |
| D. | 用Fe代替Zn,其他条件不变,绘出的图象完全相同 |
13.有机化学反应种类比较多,常见的有:①卤代反应 ②烯烃水化反应 ③氧化反应④还原反应 ⑤硝化反应 ⑥水解反应 ⑦酯化反应 ⑧消去反应 ⑨加聚反应⑩缩聚反应等等.其中属于取代反应的是( )
| A. | ①⑤⑥⑦ | B. | ②③④⑧⑨⑩ | C. | ①②⑤⑥⑦ | D. | ①⑤⑥⑦⑨⑩ |
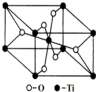 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: