题目内容
5.两支试管中分别盛有浓硫酸和稀硫酸,某同学使用的下列5种方法中,能区别出哪支试管盛浓硫酸的方法有( )①加入铜片(加热)②加入铁片③加入纸片④加入氯化钡⑤加入胆矾.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 浓硫酸和稀硫酸都属于酸,都具有酸的性质,浓硫酸还具有强氧化性、脱水性、吸水性,根据二者的区别鉴别浓硫酸和稀硫酸.
解答 解:①浓硫酸具有强氧化性,可与加入铜片在加热条件下反应,而稀硫酸不反应,据此可以鉴别浓硫酸与稀硫酸,故选;
②稀硫酸常温下与铁反应生成氢气,浓硫酸常温下与铁发生钝化,二者现象不同,据此可以鉴别浓硫酸与稀硫酸,故选;
③浓硫酸具有脱水性,滴到纸片上,能够使纸炭化变黑,稀硫酸不具有此性质,二者现象不同,据此可以鉴别浓硫酸与稀硫酸,故选;
④加入氯化钡,都生成白色沉淀,二者现象相同,不能鉴别,故不选;
⑤浓硫酸具有吸水性,加入胆矾,晶体变为无色,而稀硫酸可溶解晶体,现象不同,可鉴别,故选;
故选:C.
点评 本题考查了物质的鉴别,为高频考点,要求学生熟悉浓硫酸、稀硫酸性质,且要有实验操作的经历和分析、解决化学实验问题的能力,题目难度不大.

练习册系列答案
相关题目
15.我国“十二五”规划纲要倡导技术创新,温家宝强调稀土要可持续发展.有人发明:用一种硫酸稀土溶液离子膜可电解氧化铈(Ce2O3)成为Ce4+的溶液.使用离子交换膜将电解槽分隔为阳极室和阴极室.阳极材料是阳极液是酸性的硫酸稀土溶液.阴极液是硫酸或钠、镁、铜、镍、锰、锌等的硫酸盐溶液,或上述盐与硫酸的混和溶液.以附有Ce2O3的材料作阳极通直流电电解时,在阳极室得到含Ce4+溶液.下列有关叙述不正确的是( )
| A. | 阳极反应式为:Ce2O3-2e-+6H+═2Ce4++3H2O | |
| B. | 电解时溶液中的阳离子向阳极移动 | |
| C. | 如果阴极液是稀硫酸,电极反应式为:2H++2e-═H2↑ | |
| D. | 如果阴极液是钠、镁、铜、镍、锰、锌等的硫酸盐溶液,则在阴极室可得到铜、镍、锌、锰等金属合金粉末 |
16.如图是X、Y、Z三种液体的对应近似pH,下列判断不正确的是( )

| A. | X显酸性 | B. | Y一定是水 | ||
| C. | Z可能是碳酸钠溶液 | D. | Z可使石蕊试液变蓝 |
13.将1.92g 铜粉加入到40mL 1mol•L-1的稀硝酸溶液中,充分反应后,再向溶液中加入下列物质,充分搅拌后,铜粉仍然不能完全溶解的是( )
| A. | 40mL 1 mol•L-1的稀硝酸溶液 | B. | 40mL 0.5 mol•L-1的稀硫酸溶液 | ||
| C. | 40mL 1 mol•L-1的FeCl3溶液 | D. | 60mL 0.5 mol•L-1的稀盐酸 |
10.下列有关叙述中正确的是( )
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 难溶于水的电解质一定是弱电解质 |
14. 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
(3)下列说法正确的是BCD.
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
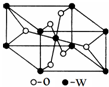
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
 ②Na2O2
②Na2O2 ③N2
③N2 ④H2O
④H2O .
.