题目内容
11.一种甲醇燃料电池以稀硫酸为电解液,其中一个电极上加入甲醇(CH3OH),同时另一个电极通入空气:(1)此电池的负极反应式是2CH3OH-12e-+2H2O=12H++2CO2↑;
(2)正极电极反应式是3O2+12e-+12H+=6H2O;
(3)电解液中的H+向正极移动.
分析 (1)负极甲醇发生氧化反应,生成二氧化碳气体;
(2)正极是氧气发生还原反应,生成水;
(3)原电池中的阳离子移动正极.
解答 解:(1)负极甲醇发生氧化反应,生成二氧化碳气体,电极反应式为:2CH3OH-12e-+2H2O=12H++2CO2↑,故答案为:2CH3OH-12e-+2H2O=12H++2CO2↑;
(2)正极是氧气发生还原反应,生成水,电极反应式为:3O2+12e-+12H+=6H2O,故答案为:3O2+12e-+12H+=6H2O;
(3)原电池中的阳离子移动正极,所以氢离子移向正极,故答案为:正.
点评 本题考查了燃料电池,根据正负极上发生的反应、电子移动方向等知识点来分析解答,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为易错点.

练习册系列答案
相关题目
7.下列有关物质性质或用途的说法正确的是( )
| A. | “油脂的氢化”称为皂化反应 | |
| B. | 以乙烯为原料可制取乙酸乙酯 | |
| C. | 苯酚溶液加入FeCl3溶液呈现红色 | |
| D. | 利用甘油与硝酸反应可制得TNT炸药 |
8.将过量的CO2分别通入到①CaCl2溶液:②Na2SiO3溶液;③Ca(OH)2溶液;④饱和Na2CO3溶液中;最终溶液中有白色沉淀析出的是( )
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ①③④ |
5.在50mL18mol•L-1的浓H2SO4中加入足量的Cu片并加热,充分反应后,被还原的H2SO4的物质的量为( )
| A. | 等于0.9mol | B. | 等于0.45mol | ||
| C. | 大于0.45mol,小于0.9mol | D. | 小于0.45mol |
16.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4溶液 | 溶液紫色褪去 | 制得的气体为乙烯 |
| B | 测定等浓度的Na2CO3和Na2SO3的溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 向2.0ml浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1AgNO3溶液,振荡 | 沉淀呈黄色 | Ksp(AgCl)>Ksp(AgI) |
| D | 向待测液中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 出现白色沉淀 | 原待测液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
20.关于下列实验装置叙述正确的是( )
| A. | 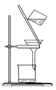 装置可用于提纯胶体 | |
| B. | 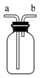 装置可用于排空气法收集气体,可收集CO2、NH3、H2等 | |
| C. |  装置可用于吸收SO2 | |
| D. |  装置可用验证浓硫酸具有强氧化性 |
1.下列有关物质的性质或该物质性质的应用均正确的是( )
| A. | 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是一样的 | |
| C. | MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |

 ,由A生成F的反应类型是加聚反应.
,由A生成F的反应类型是加聚反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.