题目内容
A元素原子M电子层上有7个电子,B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子.
(1)画出B元素的原子结构示意图
(2)A、B两元素的化合物是 (“离子化合物”或“共价化合物”).
(3)该化合物的电子式是 .
(1)画出B元素的原子结构示意图
(2)A、B两元素的化合物是
(3)该化合物的电子式是
考点:位置结构性质的相互关系应用
专题:
分析:A元素原子第三层电子层上有7个电子,所以第一和第二层已经排满,为氯元素,B元素与A元素的原子核外电子层数相同即为三层,B元素的原子最外电子层只有1个电子,所以是11号的钠元素,
(1)根据元素的原子核外电子排布规律来回答;
(2)根据元素的最外层电子数来确定化合价进而确定所形成的化合物;
(3)氯化钠为离子化合物,钠离子用离子符号表示,氯离子需要标出所带电荷及最外层电子.
(1)根据元素的原子核外电子排布规律来回答;
(2)根据元素的最外层电子数来确定化合价进而确定所形成的化合物;
(3)氯化钠为离子化合物,钠离子用离子符号表示,氯离子需要标出所带电荷及最外层电子.
解答:
解:A元素原子第三层电子层上有7个电子,所以第一和第二层已经排满,为氯元素,B元素与A元素的原子核外电子层数相同即为三层,B元素的原子最外电子层只有1个电子,所以是11号的钠元素,
(1)B为Na,钠原子的核电荷数为11,核外电子总数为11,最外层为1个电子,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)A为氯元素最外层7个电子,为-1价、B为钠元素最外层一个电子为+1价,钠和氯形成的化合物为氯化钠,化学式为NaCl,氯化钠属于离子化合物,
故答案为:离子化合物;
(3)NaCl属于离子化合物,其电子式为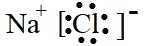 ,故答案为:
,故答案为: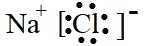 .
.
(1)B为Na,钠原子的核电荷数为11,核外电子总数为11,最外层为1个电子,其原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)A为氯元素最外层7个电子,为-1价、B为钠元素最外层一个电子为+1价,钠和氯形成的化合物为氯化钠,化学式为NaCl,氯化钠属于离子化合物,
故答案为:离子化合物;
(3)NaCl属于离子化合物,其电子式为
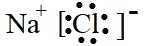 ,故答案为:
,故答案为: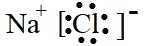 .
.
点评:本题考查了位置、结构与性质关系的应用,题目难度中等,熟练掌握原子结构与元素周期律、元素周期表的关系为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
N2(g)+3H2(g)?2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是( )
| A、N2、H2、NH3的浓度比为1:3:2的状态 |
| B、混合气体的密度不随时间而变化 |
| C、当有1mol NN键断裂时,有6mol N-H键断裂 |
| D、单位时间内消耗amol N2的同时,消耗3amol 的H2的状态 |
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2
CO2+H2O.下列有关说法正确的是( )
| 催化剂 |
| A、该反应为吸热反应 |
| B、CO2分子中的化学键为非极性键 |
| C、HCHO分子中既含σ键又含π键 |
| D、常温常压下,每生成1.8 g H2O消耗2.24 L O2 |
下列有关能量转换的说法不正确的是( )
| A、煤燃烧主要是化学能转化为光能的过程 |
| B、人类使用照明设备主要是将电能转化为光能 |
| C、动物体内葡萄糖被氧化成CO2是化学能转变成热能的过程 |
| D、化石燃料燃烧时放出的能量均于太阳能 |
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
| A、分子式为C15H12O5 |
| B、遇FeCl3溶液发生显紫色 |
| C、能与溴水反应且1molEGC消耗2molBr2 |
| D、1molEGC与4molNaOH恰好完全反应. |
实验室里运用下列实验装置进行实验,能达到相应实验目的是( )
A、 装置:石油分馏 |
B、 装置:溴苯的制取 |
C、 装置:乙烯的制取 |
D、 装置:乙酸乙酯的制取 |
某气态烃A,1mol能与2mol HCl完全加成生成B,B上的氢原子被Cl原子完全取代需要8mol Cl2,则A可能是( )
| A、丙炔 | B、2-丁炔 |
| C、2-丁烯 | D、2-甲基丙烯 |
下列物质属于同系物的一组是( )
| A、CH4与C2H4 |
B、 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C、C2H6与C3H8 |
| D、O2与O3 |
