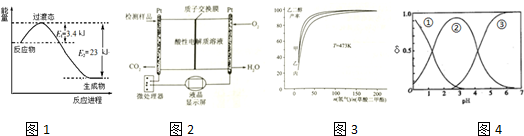
题目内容
13.下列有关实验的现象描述正确的是( )| A. | 氢气在氯气中燃烧,火焰呈淡蓝色,瓶口出现大量暈白雾 | |
| B. | 将新制的氯气通入AgNO3溶液中,白色沉淀生成. | |
| C. | 铜在氯气中燃烧,产生大量棕色的烟,加水溶解后可得蓝绿色溶液 | |
| D. | 用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
分析 A.氢气在氯气中燃烧,火焰呈苍白色;
B.氯气可与水反应生成盐酸;
C.铜和氯气反应上火车棕色的氯化铜,溶液为蓝绿色;
D.观察钾元素的焰色反应,应透过蓝色钴玻璃观察.
解答 解:A.氢气在氯气中燃烧,火焰呈苍白色,不是淡蓝色,故A错误;
B.氯气可与水反应生成盐酸,加入硝酸银溶液生成氯化银沉淀,故B正确;
C.铜和氯气反应上火车棕色的氯化铜,溶液为蓝绿色,故C正确;
D.观察钾元素的焰色反应,应透过蓝色钴玻璃观察,以避免钠元素的干扰,故D错误.
故选BC.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力以及双基的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
3.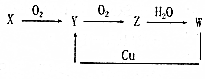 已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
 已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )| A. | X、Y、Z、W均为含有同种元素的化合物 | |
| B. | 若X能与Y反应,则X、Y-定是H2S和SO2 | |
| C. | Z→W的反应一定是氧化还原反应 | |
| D. | 在W的稀溶液滴入石蕊试剂都显红色 |
4.下列说不正确是( )
| A. | 分子间作用力越弱,分子晶体的熔点越低 | |
| B. | 氯化铵受热分解,断裂离子键和共价键 | |
| C. | 金刚石、C60都不存在独立的小分子 | |
| D. | 断裂化学键,需要吸收能量 |
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式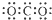 | B. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | ||
| C. | 乙烯的结构简式C2H4 | D. | Cl-的结构示意图: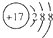 |
18.化学与环境、生活息息相关,下列说法错误的是( )
| A. | 葡萄糖能用于补钙药物的合成 | |
| B. | 燃料不完全燃烧排放的CO是大气污染物之一 | |
| C. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| D. | 自来水厂可使用Cl2和FeSO4•7H2O进行消毒、净化、以改善水质 |
2.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法正确的是( )


| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | 此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同 |
3.NA为阿伏伽德罗常数的值,下列叙述错误的是( )
| A. | 两份质量均为27 g的 Al分别与足量NaOH溶液和足量的盐酸反应转移电子均为3NA | |
| B. | 1mol氯气与足量的铁反应,转移电子数目是3NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3 NA | |
| D. | 23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |