题目内容
14.下面是印刷电路板的生产及其废液的处理的流程简图.请按要求填空: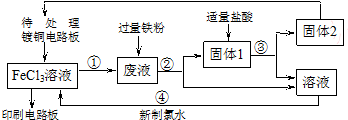
(1)镀铜电路版制成印刷电路版的离子方程式为2Fe3++Cu═Cu2++2Fe2+;固体1的化学成分是Fe、Cu(填化学式).
(2)反应①的化学方程式为2FeCl3+Cu=2FeCl2+CuCl2;要检验废液中是否含有Fe3+所需的试剂是KSCN(填化学式)溶液.
(3)反应④的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
分析 待处理镀铜电路板与氯化铁溶液反应后得到的溶液中含有氯化铜、氯化亚铁及未反应的氯化铁,废液中加入足量的Fe,反应中铁离子和铜离子均可铁粉反应:2Fe3++Fe═3Fe2+,Cu2++Fe=Cu+Fe2+,过滤得到的固体1为生成的铜和过量的铁,加入适量盐酸后过滤,Fe与盐酸反应,而Cu不反应,过滤得到固体2为铜及氯化亚铁溶液,新制氯水把氯化亚铁氧化,得到氯化铁溶液.(2)中检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在,据此解答.
解答 解:待处理镀铜电路板与氯化铁溶液反应后得到的溶液中含有氯化铜、氯化亚铁及未反应的氯化铁,废液中加入足量的Fe,反应中铁离子和铜离子均可铁粉反应:2Fe3++Fe═3Fe2+,Cu2++Fe=Cu+Fe2+,过滤得到的固体1为生成的铜和过量的铁,加入适量盐酸后过滤,Fe与盐酸反应,而Cu不反应,过滤得到固体2为铜及氯化亚铁溶液,新制氯水把氯化亚铁氧化,得到氯化铁溶液.
(1)镀铜电路版制成印刷电路版是利用氯化铁溶液和铜反应生成氯化亚铁和氯化铜而实现的,离子方程式为2Fe3++Cu═Cu2++2Fe2+,废液中含有铁离子和铜离子均可以与过量铁粉反应,滤得到的固体1为生成的铜和过量的铁,
故答案为:2Fe3++Cu═Cu2++2Fe2+; Fe、Cu;
(2)反应①为铜与氯化铁溶液反应生成氯化亚铁和氯化铁,化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2,检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,
故答案为:2FeCl3+Cu=2FeCl2+CuCl2;KSCN;
(3)反应④是新制氯水把氯化亚铁氧化为三氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查化学工艺流程、物质分离提纯综合应用、元素化合物性质等知识,侧重于铁离子和亚铁离子的转化,题目难度中等,注意基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 将木炭粉碎成粉末状可以加快化学反应速率 | |
| B. | 升高温度可以加快化学反应速率 | |
| C. | 增加压强可以加快化学反应速率 | |
| D. | 增加木炭的量可以加快化学反应速 |
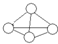 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )(NA表示阿佛加德罗常数的值 磷的相对原子质量P-31)
| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B的可能组成是SO2、H2中的一种或两种.
【实验探究】
实验室提供下列试剂:0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2溶液、淀粉溶液、蒸馏水.在配制0.01mol/L酸性KMnO4溶液溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100ml容量瓶和胶头滴管(填仪器名称).
请你完成以下探究实验.
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1mol/LKSCN溶液 ②另取适量A溶液,滴加少量0.01mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入下图所示装置 | 甲中紫色褪去,乙中不褪色,试管中收集到气体 | 含有两种气体 |

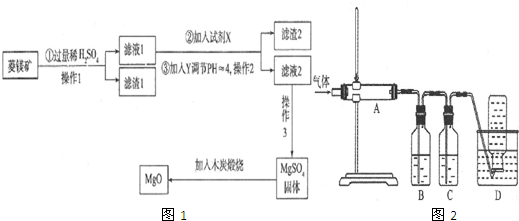
(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C $\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;800℃-900℃\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 TiCl4+O2.已知相关数据如下:
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.
(5)钛铁矿转化为粗TiO2也可以通过湿法完成:先用浓H2SO4溶解,将钛铁矿转化为TiO2+,然后使其水解得到粗TiO2.用酸清洗可除去粗TiO2中的Fe(OH)3杂质,已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下,Fe(OH)3(s)+3H+(aq)?Fe3+(aq)+3H2O(1)的平衡常数K=2.79×103.
(6)金属钛还可以通过电解直接获得.以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为TiO2+4e-=Ti+2O2-.
| A. | 质谱 | B. | 红外光谱 | C. | 紫外光谱 | D. | 核磁共振谱 |