题目内容
将一定量的乙烯和乙烷的混合气体通过足量的溴水,溴水增重8.4g,将所得气体燃烧后的产物通过浓硫酸增重5.4g,求原混合气体中乙烷的体积分数.
考点:有关混合物反应的计算,乙烯的化学性质
专题:有机物的化学性质及推断
分析:C2H6和C2H4的混合气体,通过足量的溴水充分吸收后,溴水增重8.4g为C2H4质量,浓硫酸增重的为水的质量,根据n=
计算乙烯、水的物质的量,根据质量守恒定律计算出乙烷的物质的量,相同条件下气体的体积之比等于其物质的量之比,据此计算出原混合气体中乙烷的体积分数.
| m |
| M |
解答:
解:C2H6和C2H4的混合气体,通过足量的溴水充分吸收后,溴水增重的8.4g为C2H4的质量,乙烯的物质的量为:
=0.3mol,0.3mol乙烯分子中含有H原子的物质的量为:0.3mol×4=1.2mol;
则乙烷的质量为:29.5g-7g=22.5g,
将所得气体燃烧后的产物通过浓硫酸增重5.4g,浓硫酸增重的为水的质量,则水的物质的量为:
=0.3mol,0.3mol水中含有0.6molH原子,
则需要乙烷提供的H原子的物质的量为:1.2mol-0.6mol=0.6mol,
混合气体中乙烷的物质的量为:n(C2H6)=
=0.1mol,
相同条件下气体的体积之比大于其物质的量之比,
则混合气体中乙烷占混合气体的体积分数为:
×100%=25%,
答:原混合气体中乙烷的体积分数25%.
| 8.4g |
| 28g/mol |
则乙烷的质量为:29.5g-7g=22.5g,
将所得气体燃烧后的产物通过浓硫酸增重5.4g,浓硫酸增重的为水的质量,则水的物质的量为:
| 5.4g |
| 18g/mol |
则需要乙烷提供的H原子的物质的量为:1.2mol-0.6mol=0.6mol,
混合气体中乙烷的物质的量为:n(C2H6)=
| 0.6mol |
| 6 |
相同条件下气体的体积之比大于其物质的量之比,
则混合气体中乙烷占混合气体的体积分数为:
| 0.1mol |
| 0.3mol+0.1mol |
答:原混合气体中乙烷的体积分数25%.
点评:本题考查混合物的有关计算、烯烃的化学性质,题目难度中等,明确烯烃与烷烃的化学性质为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
取一定量的镁、铝合金,用足量盐酸溶解后,再加入过量的氢氧化钠溶液,然后滤出沉淀物,加强热灼烧最后得到白色粉末,干燥后称量与原合金的质量相等,则合金中镁的质量百分含量是( )
| A、20% | B、40% |
| C、60% | D、无法计算 |
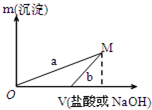 某同学设计了两种方案制备氢氧化铝.
某同学设计了两种方案制备氢氧化铝.方案一:2.7g Al
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A、a曲线表示的是向X溶液中加入NaOH溶液 |
| B、在M点时,两种方案中所得溶液的溶质质量分数相同 |
| C、方案二比方案一生成更多的气体 |
| D、M点以后,a、b两条曲线将重合为一条 |
某有机物可被氧化为甲、也可被还原为乙,甲和乙都能跟钠反应放出氢气,且甲、乙在浓硫酸催化下反应生成丙,丙能发生银镜反应,丙的结构简式是( )
| A、CH3COOCH3 |
| B、HCOOCH3 |
| C、HCOOCH2CH3 |
| D、HCOOCH2CH2CH3 |
下列操作或发生事故时的处理方法正确的是( )
| A、浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,再涂上3%~5%的小苏打溶液 |
| B、给试管里的液体加热时,试管应与桌面垂直 |
| C、配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线 |
| D、将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 |
水的三态的熵值的大小关系正确的是(Sm表示1mol物质的熵值)( )
| A、Sm(s)>Sm(l)>Sm(g) |
| B、Sm(l)>Sm(s)>Sm(g) |
| C、Sm(g)>Sm(l)>Sm(s) |
| D、Sm(s)=Sm(l)=Sm(g) |
 和
和 ⑦
⑦ 和
和 ⑧CH3CH=CHCH2OH和HOCH2CH=CH2
⑧CH3CH=CHCH2OH和HOCH2CH=CH2