题目内容
某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:海水



 Br2(g)
Br2(g)
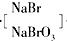
 Br2
Br2(1)取24L除去悬浮杂质后的海水,浓缩至2L;
(2)向其中通入足量Cl2,反应的离子方程式:______,通入热空气的目的:______;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:______,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:______,理论上可以得到Br2的质量为______;
(5)请计算海水中溴的浓度为______g/L.
【答案】分析:(2)根据氯气具有氧化性,能氧化溴离子生成单质溴;根据溴易挥发;
(3)根据反应物、生成物,利用化合价升降总数相等和质量守恒来配平;
(4)根据Br-和BrO3-在酸性条件下发生归中反应生成Br2;根据各步反应,可确定如下关系:CaCO3~CO2~Br2,根据CaCO3的质量求出Br2的质量.
(5)根据C= 来计算;
来计算;
解答:解析:通过反应Cl2+2Br-═Br2+2Cl-置换出溴单质后,一般用热空气或水蒸气将Br2吹出;根据各步反应,可确定如下关系:Br2~CO2~CaCO3,根据CaCO3的质量
可求出原24L海水中Br2的质量为 =1.6 g,
=1.6 g,
则海水中溴的浓度为 =0.067 g/L.
=0.067 g/L.
解:(2)因氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-═Br2+2Cl-;
因溴易挥发,所以一般用热空气或水蒸气将Br2吹出,故答案为:将Br2吹出;
(3)生成一个NaBr化合价降低1,生成一个NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒来配平得:
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(4)因Br-和BrO3-在酸性条件下发生归中反应生成Br2:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,
故答案为:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O;
根据各步反应,得如下关系:CaCO3 ~CO2~Br2
100 160
1g 1.6 g
所以得到Br2的质量为1.6g,故答案为:1.6 g;
(5)海水中溴的浓度为 =0.067 g/L,故答案为:0.067.
=0.067 g/L,故答案为:0.067.
点评:本题结合海水提取溴的过程,考查了氧化还原反应、化学计算、方程式的书写,难度中等,在配平时抓住化合价升降总数相等.
(3)根据反应物、生成物,利用化合价升降总数相等和质量守恒来配平;
(4)根据Br-和BrO3-在酸性条件下发生归中反应生成Br2;根据各步反应,可确定如下关系:CaCO3~CO2~Br2,根据CaCO3的质量求出Br2的质量.
(5)根据C=
 来计算;
来计算;解答:解析:通过反应Cl2+2Br-═Br2+2Cl-置换出溴单质后,一般用热空气或水蒸气将Br2吹出;根据各步反应,可确定如下关系:Br2~CO2~CaCO3,根据CaCO3的质量
可求出原24L海水中Br2的质量为
 =1.6 g,
=1.6 g,则海水中溴的浓度为
 =0.067 g/L.
=0.067 g/L.解:(2)因氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-═Br2+2Cl-;
因溴易挥发,所以一般用热空气或水蒸气将Br2吹出,故答案为:将Br2吹出;
(3)生成一个NaBr化合价降低1,生成一个NaBrO3化合价升高5,根据化合价升降总数相等和质量守恒来配平得:
3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,故答案为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(4)因Br-和BrO3-在酸性条件下发生归中反应生成Br2:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,
故答案为:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O;
根据各步反应,得如下关系:CaCO3 ~CO2~Br2
100 160
1g 1.6 g
所以得到Br2的质量为1.6g,故答案为:1.6 g;
(5)海水中溴的浓度为
 =0.067 g/L,故答案为:0.067.
=0.067 g/L,故答案为:0.067.点评:本题结合海水提取溴的过程,考查了氧化还原反应、化学计算、方程式的书写,难度中等,在配平时抓住化合价升降总数相等.

练习册系列答案
相关题目
 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
 (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
