题目内容
下列说法不正确的是( )
| A、1mol某粒子集体所含该粒子数与0.012kg12C中所含碳原子数相同 |
| B、1mol任何粒子的粒子数叫做阿伏加德罗常数,通常表示为6.02×1023mol-1 |
| C、O22-的摩尔质量为34g/mol |
| D、常温常压下28g N2所含分子数约为6.02×1023 |
考点:阿伏加德罗常数,摩尔质量,物质的量的相关计算
专题:
分析:A、1mol任何物质中均含有阿伏伽德罗常数个微粒;
B、1mol任何物质中均含有阿伏伽德罗常数个微粒;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量;
D、根据n=
和N=n?NA来计算.
B、1mol任何物质中均含有阿伏伽德罗常数个微粒;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量;
D、根据n=
| m |
| M |
解答:
解:A、1mol任何物质中均含有阿伏伽德罗常数个微粒,而0.012kg12C中所含碳原子数称为阿伏伽德罗常数,故A正确;
B、将阿伏伽德罗常数个微粒看做一个整体,称为阿伏伽德罗常数,单位为mol-1,故B正确;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量,故O22-的摩尔质量应为32g/mol,故C错误;
D、28g N2的物质的量n=
=
=1mol,分子数N=nM=1mol×NA=6.02×1023,故D正确.
B、将阿伏伽德罗常数个微粒看做一个整体,称为阿伏伽德罗常数,单位为mol-1,故B正确;
C、一种物质的摩尔质量在数值上等于该物质的相对分子质量或相对原子质量,故O22-的摩尔质量应为32g/mol,故C错误;
D、28g N2的物质的量n=
| m |
| M |
| 28g |
| 28g/mol |
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
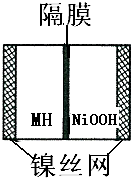 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、电池的电解液可为稀H2SO4溶液 |
| C、充电时负极反应为:MH+OH--e-═H2O+M |
| D、MH是一类储氢材料,其所含氢密度越大,电池的能量密度越高 |
把4g NaOH固体溶于水,配成1L 溶液,溶液中NaOH的物质的量浓度是( )
| A、2 mol/L |
| B、0.2 mol/L |
| C、1 mol/L |
| D、0.1mol/L |
下列表示对应化学反应的离子方程式正确的是( )
| A、SO2通入FeCl3溶液中:SO2+Fe3++2H2O═SO42-+Fe2++4H+ | ||||
B、用两个铜电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、NO2通入水中:3NO2+H2O═2H++2NO3-+NO | ||||
| D、过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
下列分子或离子中,含有孤对电子的是( )
| A、BF3 |
| B、CH4 |
| C、PCl3 |
| D、NH4+ |
