题目内容
13.如图是常见四种有机物的比例模型示意图.下列说法正确的是( )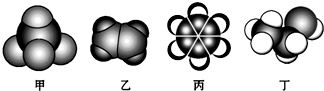
| A. | 甲中有少量乙杂质,可以通入到酸性高锰酸钾溶液中,洗气除杂 | |
| B. | 乙烷中有少量乙杂质,可以通入到溴水中,洗气除杂 | |
| C. | 丙中有少量苯酚杂质,可以先加浓溴水,然后静置,过滤除杂 | |
| D. | 丁有少量乙酸杂质,可以加少量浓硫酸并加热除杂 |
分析 由图可知,甲为甲烷,乙为乙烯,丙为苯,丁为乙醇.
A.乙烯含有碳碳双键,可被高锰酸钾氧化生成二氧化碳气体;
B.乙烯中含双键,可与溴水发生加成反应;
C.溴以及三溴苯酚都溶于苯;
D.乙醇与乙酸发生酯化反应.
解答 解:由图可知,甲为甲烷,乙为乙烯,丙为苯,丁为乙醇.
A.乙烯含有碳碳双键,可被高锰酸钾氧化生成二氧化碳气体,引入新杂质,应加入溴水除杂,故A错误;
B.乙烯中含双键,可与溴水发生加成反应,可用于除杂,故B正确;
C.溴以及三溴苯酚都溶于苯,应加入氢氧化钠溶液除杂,故C错误;
D.乙醇与乙酸发生酯化反应,二者沸点不同,可用蒸馏的方法除杂,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握比例模型及对应化合物的性质为解答的关键,侧重常见几种烃和乙醇性质及结构的考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
3. 氨是一种重要的化工产品.
氨是一种重要的化工产品.
(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+$\frac{1}{2}$O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)??H2(g)+$\frac{1}{2}$O2(g)△H=+249kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是BDE.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
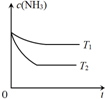
(3)反应2NH3(g)??N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1小于T2,平衡常数K(T1)小于K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为0.09mol.反应在0~5min区间的平均反应速率v(N2)=0.004mol/(L•min).
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则反应在该温度下平衡常数K=2.37(保留三三位有效数字);保持温度不变,30min时再向该密闭容器中投入0.5molN2、0.5molH2和1molNH3,此时反应将正向进行(填“正向进行”、“逆向进行”或“处于平衡状态”).
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 氨是一种重要的化工产品.
氨是一种重要的化工产品.(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+$\frac{1}{2}$O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)??H2(g)+$\frac{1}{2}$O2(g)△H=+249kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是BDE.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)反应2NH3(g)??N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1小于T2,平衡常数K(T1)小于K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为0.09mol.反应在0~5min区间的平均反应速率v(N2)=0.004mol/(L•min).
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
8.下列化学用语表述一定正确的是( )
| A. | 甲醛的电子式: | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
18.某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(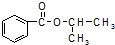 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:
合成苯甲酸异丙酯粗产品:
在如图圆底烧瓶中加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,小心加热30分钟,使反应充分,得苯甲酸异丙酯粗产品.
(1)加入碎瓷片的目的是防止暴沸;
(2)异丙醇的系统命名法的名称为2-丙醇;
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式 .
.
粗产品的精制:
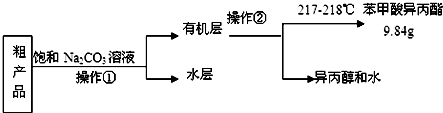
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是分液漏斗;操作②的名称是蒸馏.
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为60%.
(6)该实验中不能用下列那个选项所对应的措施来提高苯甲酸甲酯的产率A.
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL.
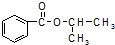 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
在如图圆底烧瓶中加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,小心加热30分钟,使反应充分,得苯甲酸异丙酯粗产品.
(1)加入碎瓷片的目的是防止暴沸;
(2)异丙醇的系统命名法的名称为2-丙醇;
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
 .
.粗产品的精制:
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是分液漏斗;操作②的名称是蒸馏.

(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为60%.
(6)该实验中不能用下列那个选项所对应的措施来提高苯甲酸甲酯的产率A.
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL.
5.硒为第四周期VIA族元素,根据它在周期表中位置推测,硒不可能具有的性质( )
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
2.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: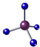 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: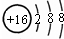 |

 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.